题目内容
(13分)1 000 mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):
(1)写出生成白色沉淀B的离子方程式:___________________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:________________________________________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________________。
②沉淀A中能与稀硝酸反应的成分是______________________________(写化学式)。
(13分)
(1)HCO3-+OH-+Ba2+=BaCO3↓+H2O (2分)
(2)Fe3+、Ba2+(2分)
(3)①(3分)阴离子 Cl- Br- CO32- HCO3- SO32- SO42- 浓度/mol·L-1 ? 0 0.1 0.1 0 0.05
②存在,其最小物质的量浓度为0.1mol·L-1((2分)
(4)①CO32、-HCO3-、SO32-(2分)②BaCO3、BaSO4(2分)
解析试题分析:由实验操作加入BaCl2得到的沉淀A加入硝酸得到白色沉淀D为BaSO4其物质的量为0.05mol,证明原溶液中至少含有SO32-和SO42-中一种,原溶液中无Ba2+,同时得到的无色气体能和石灰水反应得到白色沉淀无色气体中应哈有CO2,其物质的量为0.1mol证明溶液中有CO32-其物质的量为0.1mol且Ba2+不存在。加入NaOH溶液后得到白色沉淀,可知溶液中无Fe3+;可知气体B为NH3其物质的量为0.1mol,故溶液中含NH4+其物质的量为0.1mol,加白色沉淀B应为BaCO3,可知溶液中应含HCO3-其物质的量为0.1mol。溶液B中通入氯气得到浅黄绿色溶液,故原溶液中无Br-(1)反应的离子方程式为:HCO3-+OH-+Ba2+=BaCO3↓+H2O;(3)若无色气体D为单一气体,则D为CO2,则原溶液中有SO42-无SO32-;由以上分析可知,Na+物质的量浓度为0.2 mol·L-1、NH4+其物质的量浓度为0.1mol·L-1、CO32-物质的量浓度为0.1 mol·L-1、HCO3-物质的量浓度为0.1 mol·L、SO42-物质的量浓度为0.05 mol·L-1、Br-物质的量浓度为0 mol·L-1、Cl-物质的量浓度由K+的浓度确定,故是未知;根据电荷守恒,若溶液中无Cl-则K+的物质的量浓度为0.1mol·L-1若含有Cl-则K+的物质的量浓度最小为0.1mol·L-1(4)若无色气体D为混合气体则阴离子一定有CO32、-HCO3-、SO32-。
考点:考查氧化还原反应及计算、电荷守恒等知识点。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案现有失去标签的CaCl2.、AgNO3、HCl和Na2CO3四瓶溶液。为了确定这四种溶液成分,将他们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无现象 |
| ② | B+D | 有气体放出 |
| ③ | C+B | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
根据上述实验填空:
(1)A、B、C三瓶溶液分别是(用化学式表示):__________、____________、_____________。
(2)写出B和D反应的离子方程式:___________________________________________。
(3)说明A和B不发生反应的理由:___________________________________________。
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
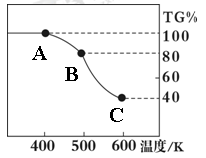
(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。