题目内容
胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式: ;
如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,原因是 ;
此时最好用含氢氧化铝的胃药(如胃舒平),写出其反应的离子方程式: 。
HCO3-+H+=CO2↑+H2O; 因产生CO2压力增大而加剧胃壁穿孔;Al(OH)3+3H+=Al3++3H2O。
解析试题分析:小苏打NaHCO3与胃酸HCl反应的化学方程式为NaHCO3+HCl=NaCl+H2O+ CO2↑,离子方程式为HCO3-+H+=CO2↑+H2O。如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打是因为小苏打与胃酸反应产生的CO2压力增大,导致胃壁变大、变薄而加剧胃壁穿孔,使胃穿孔加剧。此时最好用含氢氧化铝的胃药。该反应的离子方程式Al(OH)3+3H+=Al3++3H2O。
考点:考查治疗胃酸过多的药物的选择及应用的知识。

 名校课堂系列答案
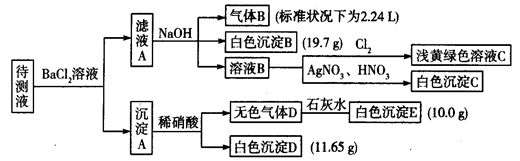
名校课堂系列答案用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ,加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是_______________________。
(2)将MnO4—氧化Fe2+的离子方程式补充完整:
1MnO4—+Fe2++________===1Mn2++Fe3++________
(3)已知:
生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释步骤Ⅱ的目的:________________________。
(4)已知:一定条件下,MnO4—可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是____________________________。
④Ⅳ中加入MnSO4的目的是__________________________。
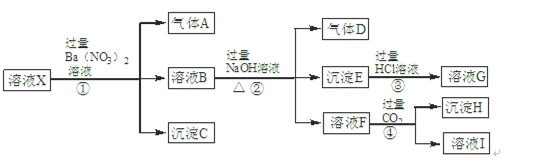
1 L 某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、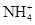 、Fe2+、Fe3+ 、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、 |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是________________。

(2)BC段的离子方程式为__________________________。
(3)V1、V2与V3、V4之间的关系为____________________。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2L |
| n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
| n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为____________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_________________。
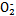 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。 )与N
)与N