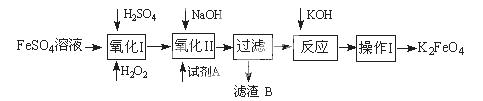
题目内容
现有失去标签的CaCl2.、AgNO3、HCl和Na2CO3四瓶溶液。为了确定这四种溶液成分,将他们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无现象 |
| ② | B+D | 有气体放出 |
| ③ | C+B | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
根据上述实验填空:
(1)A、B、C三瓶溶液分别是(用化学式表示):__________、____________、_____________。
(2)写出B和D反应的离子方程式:___________________________________________。
(3)说明A和B不发生反应的理由:___________________________________________。
(6分)(1)CaCl2; HCl; AgNO3(每空1分,共3分)
(2)2H++CO32-=CO2↑+H2O(2分)
(3)无沉淀、气体或难电离物质生成(或不具备离子反应发生的条件)(1分)
解析试题分析:HCl和Na2CO3反应生成气体,AgNO3分别与CaCl2、HCl和Na2CO3反应均生成沉淀,且CaCl2、AgNO3、HCl都能与Na2CO3反应,结合实验中B+D反应生成气体,A+D反应生成沉淀,A+B无现象,则B为HCl,D为Na2CO3,所以A为CaCl2,C为AgNO3。
(1)由上述分析可知,A为CaCl2,B为HCl,C为AgNO3。
(2)盐酸与碳酸钠反应生成氯化钠、水和二氧化碳,离子反应为2H++CO32-=CO2↑+H2O。
(3)A与B混合时没有沉淀、气体、难电离物质生成或不具备离子反应发生的条件,则不发生反应,故答案为:没有沉淀、气体、弱电解质生成或不具备离子反应发生的条件。
考点:考查无机物的推断

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
已知4℃时四种化合物在水中和液氨中的溶解度如下表:
| | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| H2O(液) | 170g | 9.2g | 1.5×10-4g | 33.3g |
| NH3(液) | 86g | 97.2g | 0.8g | 0g |
上述四种物质在水中形成复分解反应的离子方程式为 ,在液氨中形成复分解反应的化学方程式为 。