��Ŀ����
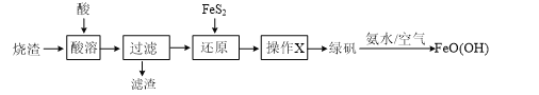
����Ŀ���̷�(FeSO4��7H2O)������ȱ����ƶѪҩƷ����Ҫ�ɷ֡��������������������������������������ʣ�Ϊԭ�����������̷���һ�ַ�����

��֪�������±���H2S��Һ��pHԼΪ3.9��SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5��
��1����ҵ�����ù���ϡ�����ܽ���м����������Ⱦ�����壬�䷴Ӧ���ӷ���ʽ��_____��
��2������II�У�ͨ�����������͵�Ŀ����_________������Һ���������ữ��pH=2��Ŀ����_____��
��3�������£�Ksp[Fe(OH)3]=4.0��10-38����Fe3+��ˮ�ⳣ��Ϊ_____��
��4������IV�õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ�����ȥ������渽�ŵ���������ʣ���_____��
��5�����õ��̷�(FeSO4��7H2O)��������O2��������������Fex(OH)y(SO4)z��wH2O���ֲⶨ����ɣ��������£��������ʲ����뷴Ӧ����ÿ����Ӧ����ȫ���У���
��ȡ���ȷݹ�����Ʒ��
��һ����Ʒ������ϡ�����ܽ����250mL����ƿ�ж��ݣ���ȡ25.00mL������Һ����ƿ�У���0.03mol/LKMnO4��Һ�ζ����յ㣬����KMnO4��Һ���Ϊ20.00mL���ζ�ʱ��Ӧ�����ӷ���ʽΪ��5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O�����ζ�����Һ������pH����Fe3+�����ˡ�ϴ�ӡ���ɲ����գ����յõ�0.32gFe2O3��(Fe2O3ʽ��160)
�ڶ�����Ʒ������ϡ�����ܽ���ټ������BaCl2��Һ�������ˡ�ϴ�ӡ���ɣ���9.32gBaSO4������(BaSO4ʽ��233)
��������Ʒ�����³�����պ��ռ���4.05gH2O�����Ƶ�������(Fex(OH)y(SO4)z��wH2O)�Ļ�ѧʽ��д��������̣�x��y��z��wΪ��������ȣ�______________________________________________________��
���𰸡�3Fe+8H�� +2NO3��=3Fe2�� +2NO+4H2O ���������ӣ���ֹ�������ӱ����� ��ȥ��������Sn2���� 2.5��10-5�� ����ϴ�ӹ�����FeSO4��7H2O����� 4:1:4:22
��������
��м����ϡ�����������������������������˺�õ���Һ������Һ����ϡ�����ữ����ͨ�����⣬������SnS��������ֹ�������ӱ����������˺�õ���ҺΪ����������������Ũ���ᡢ��ȴ�ᾧ�����˿ɵõ�FeSO4��7H2O
��1����ҵ�����ù���ϡ�����ܽ���м����������Ⱦ�����壬�䷴Ӧ���ӷ���ʽ�� 3Fe+8H�� +2NO3��=3Fe2�� +2NO+4H2O ���ʴ�Ϊ��3Fe+8H�� +2NO3��=3Fe2�� +2NO+4H2O��
��2���������̹�ϵͼ������ͨ�������Ʊ��ͣ�������ǿ��ԭ����Ŀ���dz��������ӣ���ֹ�������ӱ���������H2S������Һ�У�SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0�����������ϡ���������ҺPH=2Ϊ�˳�ȥ��������Sn2�����ʴ�Ϊ�����������ӣ���ֹ�������ӱ���������ȥ��������Sn2����
��3�� �����£�Ksp[Fe(OH)3]=4.0��10-38��Fe3��+3H2O Fe(OH)3+3H����Fe3+��ˮ�ⳣ��Ϊ
![]() =2.5��10-5���ʴ�Ϊ��2.5��10-5����
=2.5��10-5���ʴ�Ϊ��2.5��10-5����
��4������IV�õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ��ٳ�ȥ������渽�ŵ���������ʣ��ڱ�ˮ�¶ȵͣ������ܽ�ȼ�С������ϴȥ����������������ӣ������̷��ܽ��������ʧ���ʴ�Ϊ������ϴ�ӹ�����FeSO4��7H2O����ģ�
��5����һ����Ʒ��n(Fe2+)=![]() =0.03mol��n(Fe3+)=
=0.03mol��n(Fe3+)=![]() =0.04mol-0.03mol=0.01mol���ڶ�����Ʒn(SO42��)=
=0.04mol-0.03mol=0.01mol���ڶ�����Ʒn(SO42��)=![]() =0.04mol����������Ʒ��n(H2O)=
=0.04mol����������Ʒ��n(H2O)=![]() =0.225mol,���ݵ���غ㣺n(OH��)=0.01��3+0.03��2-0.04��2=0.01mol,�ᾧˮΪ0.225mol-0.01mol��
=0.225mol,���ݵ���غ㣺n(OH��)=0.01��3+0.03��2-0.04��2=0.01mol,�ᾧˮΪ0.225mol-0.01mol��![]() =0.22mol,x:y:z:w=(0.01+0.03):0.01:0.04:0.22=4:1:4:22��
=0.22mol,x:y:z:w=(0.01+0.03):0.01:0.04:0.22=4:1:4:22��
�ʴ�Ϊ��4:1:4:22��

 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�����Ŀ��ijͬѧ������ͼװ�ý�����Ȫʵ�飬��֪Բ����ƿ�ڳ���X���壬��ͷ�ι���װ������YҺ�壬�ձ���װ������ZҺ�壬��������ܽ�����Ȫʵ��������Һ��һ���ܳ���������ƿ����
X���� | Y�Լ� | Z�Լ� | |
A | NO2 | H2O | H2O |
B | HCl | H2O | H2O |
C | HCl��O2������� | H2O | H2O |
D | NH3��N2������� | H2O | H2O |

A. A B. B C. C D. D