题目内容
【题目】CO,CH4均为常见的可燃气体。
(1)等体积的CO,CH4在相同的条件下分别完全燃烧,转移的电子数之比为___。
(2)120℃,101kPa下,amL由CO,CH4组成的混合气体在bmL氧气中完全燃烧后,恢复至原来的温度与压强。
①若混合气体与氧气恰好完全反应,产生bmLCO2,则混合气体中CH4的体积分数为__。
②若燃烧后气体体积缩小了![]() mL,则a与b关系的数学表达式为__。
mL,则a与b关系的数学表达式为__。
【答案】1:4 0.33 b≥![]() a
a
【解析】
(1)相同条件下,体积之比等于物质的量之比,等体积即为等物质的量的CO、CH4完全燃烧都生成二氧化碳,碳元素的化合价变化分别为2、8;
(2)①燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),根据碳原子守恒可知,V(CO+CH4)=V(CO2),故a=b,联立方程可得答案;
②燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),燃烧后体积变化由CO燃烧导致,则: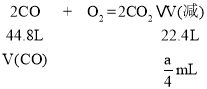 根据完全燃烧可计算答案。
根据完全燃烧可计算答案。
(1)相同条件下,体积之比等于物质的量之比,等体积即为等物质的量的CO、CH4完全燃烧都生成二氧化碳,碳元素的化合价变化分别为2、8,二者完全燃烧转移电子数之比=2:8=1:4,故答案为:1:4;
(2)①燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),根据碳原子守恒可知,V(CO+CH4)=V(CO2),故a=b,则:V(CO)+V(CH4)=a,0.5V(CO)+2V(CH4)=a,解得V(CO)=![]() ,V(CH4)=
,V(CH4)=![]() ,故混合气体中CH4的体积分数为0.33,故答案为:0.33;
,故混合气体中CH4的体积分数为0.33,故答案为:0.33;
②燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),燃烧后体积变化由CO燃烧导致,则: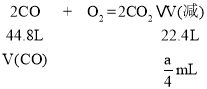 ,故V(CO)=0.5amL,V(CH4)=0.5amL,由于完全燃烧,故0.5V(CO)+2V(CH4)≤b,即0.5a×0.5+2×0.5a≤b,故b≥
,故V(CO)=0.5amL,V(CH4)=0.5amL,由于完全燃烧,故0.5V(CO)+2V(CH4)≤b,即0.5a×0.5+2×0.5a≤b,故b≥![]() a,故答案为:b≥
a,故答案为:b≥![]() a。
a。

 阅读快车系列答案
阅读快车系列答案