��Ŀ����
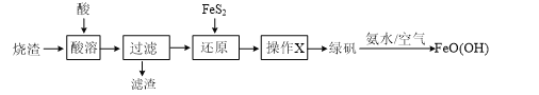
����Ŀ������������������Ҫ��Fe2O3��SiO2���Ʊ��̷���FeSO4��7H2O������ͨ���̷��Ʊ�����[FeO(OH)]���������£�����֪FeS2��������������ˮ��
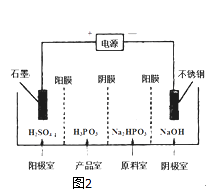
��1���������������У���ò���___________________�����������������������������������ܽ�������
��2��д������ԭ�����跢����Ӧ�����ӷ���ʽ��___________________��
��3���ԡ���ԭ�������Һ����������X�����ɵõ��̷���������X����ָ___________________�����ˣ�ϴ�ӣ����
��4���벹���������顰��ԭ����������Һ���Ƿ���Fe3+��ʵ�鷽����ȡ����ԭ������Һ���Թ��ڣ�___________________��
��5�����һ���Ʊ������ķ�Ӧ�У�������һ�ֿ������ʵ����ʣ����Ļ�ѧʽΪ___________________��
���𰸡� ���� 14Fe3����FeS2��8H2O=15Fe2����2SO![]() ��16H�� ����Ũ�������½ᾧ ����KSCN��Һ�������ֺ�ɫ����˵����Һ�к���Fe3�����������ֺ�ɫ����˵����Һ�в�����Fe3�� (NH4)2SO4
��16H�� ����Ũ�������½ᾧ ����KSCN��Һ�������ֺ�ɫ����˵����Һ�к���Fe3�����������ֺ�ɫ����˵����Һ�в�����Fe3�� (NH4)2SO4
����������1�����̷����������Ϊ��������ӣ����������������У���ò����������ܽ�������
��2������֪������������Ҫ��Fe2O3��SiO2����������������������ҺΪ��������Һ���������ԭ�����跢��FeS2��ԭFe3+�ķ�Ӧ���������������ԭ������X�õ��̷��ɵã�-1��S��������+6�۴�����SO42-�У�������ԭ�����跢����Ӧ�����ӷ���ʽΪ��14Fe3+��FeS2��8H2O=15Fe2+��2SO42-��16H+��
��3������ԭ����õ�����������Һ���ɾ�������Ũ�������½ᾧ�����̷�������������X����ָ������Ũ�������½ᾧ�����ˣ�ϴ�ӣ����
��4��������Fe3+��SCN-����Ϸ�Ӧ��������ԭ����������Һ���Ƿ���Fe3+������ʵ�鷽��Ϊ��ȡ����ԭ������Һ���Թ��ڣ�����KSCN��Һ������Һ���ֺ�ɫ����˵����Һ�к���Fe3+���������ֺ�ɫ����˵����Һ�в�����Fe3+��
��5�������У��̷��백ˮ������������������[FeO(OH)]��+2��Fe��������+3�ۣ����ݵ����غ㼰ԭ���غ�ɵã�4FeSO4+8NH3+6H2O+O2=4FeO(OH)+4(NH4)2SO4�����Ի�����һ�ֿ������ʵ�����Ϊ��(NH4)2SO4��