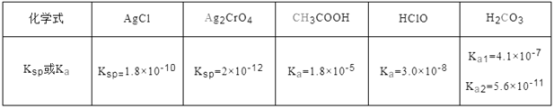
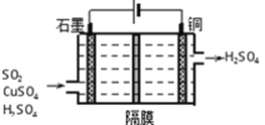
题目内容
【题目】下图是元素周期表的一部分,元素①~⑨在周期表中的位置如图所示,请回答下列问题:
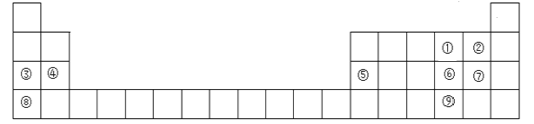
(1)元素⑨在周期表中的位置是_______。
(2)元素①~⑨中,非金属性最强的元素是_______(填元素符号)。
(3)元素①~⑨中,最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),它与元素⑤的最高价氧化物对应水化物反应的离子方程式为_______。
(4)元素⑨的简单氢化物与元素⑦的简单氢化物中更稳定的是_______(填化学式)。
(5)元素③与元素①形成的淡黄色化合物的电子式为_______。
(6)元素①的简单氢化物比元素⑥的简单氢化物的沸点_______(填“高”或“低”),原因是_______。
(7)元素④与元素⑦形成的化合物是_______(填“离子”或“共价”)化合物,用电子式表示其形成过程_______。
【答案】第四周期第VIA族 F KOH OH- + Al(OH)3= AlO2- +2H2O HCl ![]() 高 水分子间存在氢键 离子
高 水分子间存在氢键 离子 ![]()
【解析】
由图中元素所在位置,并与元素周期表进行对照,可确定①为氧(O)、②为氟(F)、③为钠(Na)、④为镁(Mg)、⑤为铝(Al)、⑥为硫(S)、⑦为氯(Cl)、⑧为钾(K)、⑨为硒(Se)。
(1)元素⑨为硒(Se),它是34号元素,在周期表中的位置是第四周期第VIA族。答案为:第四周期第VIA族;
(2)同周期元素,从左往右,非金属性依次增强;同主族元素,从下到上,非金属性依次增强,所以非金属性最强的元素位于周期表的左上角(稀有气体除外),从而得出元素①~⑨中,非金属性最强的元素是F。答案为:F;
(3)元素①~⑨中,金属性最强的元素是钾,所以最高价氧化物对应的水化物中,碱性最强的是KOH,KOH与Al(OH)3反应生成KAlO2和水,反应的离子方程式为OH- + Al(OH)3= AlO2- +2H2O。答案为:KOH;OH- + Al(OH)3= AlO2- +2H2O;
(4)非金属性Cl>Se,氢化物的稳定性H2Se<HCl,所以更稳定的是HCl。答案为:HCl;
(5)元素③与元素①形成的淡黄色化合物为Na2O2,电子式为![]() 。答案为:
。答案为:![]() ;
;
(6)元素①的简单氢化物为H2O,元素⑥的简单氢化物为H2S,由于H2O分子间能形成氢键,而H2S分子间不能形成氢键,所以水的沸点高,原因是水分子间存在氢键。答案为:高;水分子间存在氢键;
(7)元素④与元素⑦形成的化合物是MgCl2,由Mg2+和Cl-构成,是离子化合物,电子式表示其形成过程为![]() 。答案为:水分子间存在氢键;
。答案为:水分子间存在氢键;![]() 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
Al_____Si | N____O | 金刚石_____晶体硅 | CH4____SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
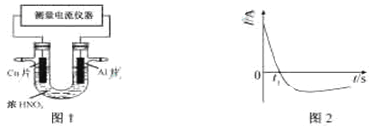
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。