��Ŀ����
����Ŀ����ĩ״����A���ɵ����ʵ�����MgO��Fe2O3��ɵĻ�����������ʵ�飺
��ȡ����A�������ȷ�Ӧ���������е���B���ɣ�
����ȡ20 g Aȫ������0.15 L 6.0 mol��L��1�����У�����ҺC��
�۽����еõ��ĵ���B����ҺC��Ӧ���ų�1.12 L(���)���壬ͬʱ������ҺD���������й�������B��
����KSCN��Һ����ʱ����ҺD����ɫ��
����գ�
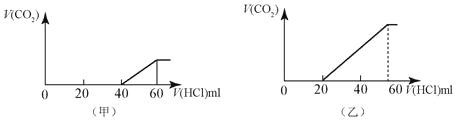
(1)�����������ȷ�Ӧ��ʵ�������___________�������еĵ���B��________��
(2)�����������ĸ���Ӧ�Ļ�ѧ����ʽ��___________��
(3)�����������ĸ���Ӧ�����ӷ���ʽ��___________��
(4)����ҺD���������Ϊ0.15 L�������Һ��c(Mg2��)Ϊ________��c(Fe2��)Ϊ________��
���𰸡�������KClO3������þ���������ȼ Fe Fe2O3��6HCl=2FeCl3��3H2O��MgO��2HCl=MgCl2��H2O Fe��2Fe3��=3Fe2����Fe��2H��=Fe2����H2�� 0.67 mol��L��1 2.3 mol��L��1
��������
(1)���ȷ�Ӧ��ָ����Al��ijЩ������������ķ�Ӧ����Ӧ�����зų������ȣ����÷�Ӧ��Ҫ�ϸߵ��¶Ȳ����������ڻ�����ϼ�����KClO3���岢����Mg������ȼMg����ų�������ʹKClO3����ֽ�ų�O2����һ���Ӿ�Mg��ȼ�գ����ڶ�ʱ����ʹ������¶�Ѹ�����ߣ�������Ӧ�������ķ�ӦΪFe2O3��2Al![]() Al2O3��2Fe�����Բ����е���BΪFe���ʴ�Ϊ��������KClO3������þ���������ȼ��Fe��
Al2O3��2Fe�����Բ����е���BΪFe���ʴ�Ϊ��������KClO3������þ���������ȼ��Fe��
(2)Fe2O3��MgO���Ǽ���������ܺ��ᷴӦ�����κ�ˮ��Fe2O3��6HCl=2FeCl3��3H2O��MgO��2HCl=MgCl2��H2O���ʴ�Ϊ��Fe2O3��6HCl=2FeCl3��3H2O��MgO��2HCl=MgCl2��H2O��
(3)�������ֻ��Fe2O3�ܺ�Al�������ȷ�Ӧ������Fe���ʡ�C��Һ���з�Ӧ���ɵ�FeCl3������δ��Ӧ��HCl�����������ӷ�ӦΪFe��2Fe3��=3Fe2����Fe��2H��=Fe2����H2����
(4)���貽�����ȥ��20 g�����У�MgO�����ʵ���Ϊx����Fe2O3�����ʵ���ҲΪx����40 g��mol��1��x��160 g��mol��1��x��20 g����ã�x��0.1 mol������MgO��MgCl2�Ĺ�ϵ������Һ��MgCl2��Ũ��Ϊ0.1 mol��0.15 L��0.67 mol��L��1�������˵����Һ��û��Fe3����Ҳ��������ΪFeCl2��MgCl2������Cl���غ�Ĺ�ϵ����֪MgCl2��FeCl2���ܵ����ʵ�������![]() ��0.45mol�����ԣ�FeCl2��Ũ��Ϊ
��0.45mol�����ԣ�FeCl2��Ũ��Ϊ![]() ��2.3 mol��L��1���ʴ�Ϊ��Fe��2Fe3��=3Fe2����Fe��2H��=Fe2����H2����0.67 mol��L��1��
��2.3 mol��L��1���ʴ�Ϊ��Fe��2Fe3��=3Fe2����Fe��2H��=Fe2����H2����0.67 mol��L��1��

 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�����Ŀ���ߴ���������Ϊ�ϳ���������Ԫ�������ϵ�ԭ�ϣ���ҵ�Ͽ�����Ȼ�������̷������̿���Fe��Al��Mg��Zn��Ni��Si��Ԫ�أ��Ʊ�����������ͼ��ʾ���ش��������⣺
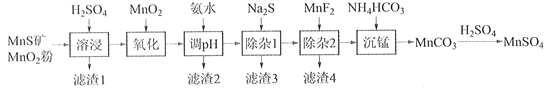
��ؽ�������[c0(Mn+)=0.1 mol��L1]�γ��������������pH��Χ���£�
�������� | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
��ʼ������pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
������ȫ��pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
��1��������1������S��__________________________��д�����ܽ����ж������������̷�Ӧ�Ļ�ѧ����ʽ____________________________________________________��
��2����������������������MnO2�������ǽ�________________________��
��3������pH��������������Һ��pH��ΧӦ����Ϊ_______~6֮�䡣
��4��������1����Ŀ���dz�ȥZn2+��Ni2+��������3������Ҫ�ɷ���______________��
��5��������2����Ŀ��������MgF2������ȥMg2+������Һ��ȹ��ߣ�Mg2+��������ȫ��ԭ����_____________________________________________________________________��
��6��д���������������ӷ���ʽ___________________________________________________��
��7����״��������Ԫ���Ͽ���Ϊ����ӵ���������ϣ��仯ѧʽΪLiNixCoyMnz2������Ni��Co��Mn�Ļ��ϼ۷ֱ�Ϊ+2��+3��+4����x=y=![]() ʱ��z=___________��
ʱ��z=___________��
����Ŀ����ͼ��ʾ������������̽��NH3�����ʡ�ʵ��ʱ��NaOH�����ϵμ���Ũ��ˮ����������һ������������档�±��ж�ʵ�����������Ľ�����ȷ����(����)
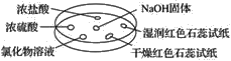
ѡ�� | ʵ������ | ���� |
A | Ũ���ḽ���������� | NH3��Ũ���ᷴӦ������NH4Cl���� |
B | Ũ���ḽ������������ | NH3��Ũ���������Ӧ |
C | �Ȼ�����Һ����� | ����Һһ����AlCl3��Һ |
D | �����ʯ����ֽ����ɫ��ʪ���ʯ����ֽ���� | NH3��һ�ֿ����Լ� |
A.AB.BC.CD.D
����Ŀ����1�������£�2g����C6H6����ȫȼ������Һ̬ˮ��CO2���ų�83.6kJ��������д��1molC6H6��ȫȼ�յ��Ȼ�ѧ����ʽ��______��
��2����֪��Fe2O3��s��+![]() C��s��=
C��s��=![]() CO2��g��+2Fe��s����H=+akJmol-1��C��s��+O2��g��=CO2��g����H=-bkJmol-1����2Fe��s��+
CO2��g��+2Fe��s����H=+akJmol-1��C��s��+O2��g��=CO2��g����H=-bkJmol-1����2Fe��s��+![]() O2��g��=Fe2O3��s���ġ�H=________��
O2��g��=Fe2O3��s���ġ�H=________��
��3����֪���ֻ�ѧ���ļ��������ʾ��
��ѧ�� | Cl��Cl | F��F | Cl��F |
����/ kJ��mol��1 | 242 | 159 | 172 |
��ӦCl2(g)+3F2(g)![]() 2ClF3(g)�ġ�H=_____________ kJ��mol-1��
2ClF3(g)�ġ�H=_____________ kJ��mol-1��
��4����ͼ�����顢������ȼ�չ����е������仯ͼ��
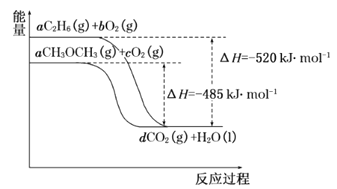
��ش��������⣺
�������ȼ������H=_______kJ��mol-1��
�ڸ�����ͼд����������ȫȼ��ʱ���Ȼ�ѧ����ʽ__________��
����Ŀ��̽��CO��NO2����������������Ӧ�������Դ�������������Ⱦ���������Ҫ���塣�ش��������⣺
I.CO������H2��Ӧ�Ʊ��ϳ���Ȼ��(SNG)���漰��Ӧ���£�
CO���黯��CO(g)+3H2(g)CH4(g)+H2O(g)![]() 1=��206.2kJ��mol-1
1=��206.2kJ��mol-1
ˮú���任��CO(g)+H2O(g)CO2(g)+H2(g)![]() 2=��41.2kJ��mol-1
2=��41.2kJ��mol-1
(1)��ӦCO2(g)+4H2(g) CH4(g)+2H2O(g)��![]() =_____kJ��mol-1��ij�¶��£��ֱ�����ʼ�����ͬ�ĺ�������A����ѹ����B�м���1molCO2��4molH2�Ļ�����壬��������Ӧ��ƽ���ų������յ������϶����_____(����A������B��)��
=_____kJ��mol-1��ij�¶��£��ֱ�����ʼ�����ͬ�ĺ�������A����ѹ����B�м���1molCO2��4molH2�Ļ�����壬��������Ӧ��ƽ���ų������յ������϶����_____(����A������B��)��
(2)�ں�ѹ�ܵ���Ӧ���н�ԭ����H2��CO��һ������ͨ�룬�ڴ����������Ʊ��ϳ���Ȼ����400����p��Ϊ100kPaʱ��Ӧ��ϵƽ����������ʾ��
��� | CH4 | H2O | H2 | CO2 | CO |
������� | 45.0 | 42.5 | 10.0 | 2.00 | 0.500 |
��������CO����ת��������______�������ܵ���Ӧ��������500������Ӧ�ﵽƽ���CH4���������![]() ______45.0%(����>������������������)��
______45.0%(����>������������������)��
II.NO2�ɷ������۷�Ӧ����N2O4����ѧ����ʽΪ2NO2![]() N2O4���÷�Ӧ�ﵽƽ��������¶ȿ�ʹ��ϵ��ɫ���
N2O4���÷�Ӧ�ﵽƽ��������¶ȿ�ʹ��ϵ��ɫ���
(3)��֪�÷�Ӧ������Ӧ���ʷ���Ϊ����=k����c2(NO2)���淴Ӧ���ʷ���Ϊ����=k����c(N2O4)������k����k���ֱ�Ϊ�����淴Ӧ�����ʳ���������ͼ(lgk��ʾ���ʳ����Ķ�����![]() ��ʾ�¶ȵĵ���)��ʾ������������������б���У��ܱ�ʾlgk����
��ʾ�¶ȵĵ���)��ʾ������������������б���У��ܱ�ʾlgk����![]() �仯��ϵ����б��______���ܱ�ʾlgk����
�仯��ϵ����б��______���ܱ�ʾlgk����![]() �仯��ϵ����б��______��
�仯��ϵ����б��______��

(4)ͼ��A��B��C��D���������ֱ�Ϊa+1.5��a+0.5��a��0.5��a��1.5����T1�¶�ʱ��ѧƽ�ⳣ��K=______mol��1��L����֪T1�¶�ʱ��ijʱ�̺����ܱ�������NO2��N2O4Ũ�Ⱦ�Ϊ0.2mol��L��1����ʱ����______����(��>��)���÷�Ӧ�ﵽƽ��������¶ȴ�T1���ߵ�T2���´ﵽƽ�⣬��T1�¶�ʱƽ��ѹǿp(T1)______T2�¶�ʱƽ��ѹǿp(T2)(����>������=����������)��ԭ����______��