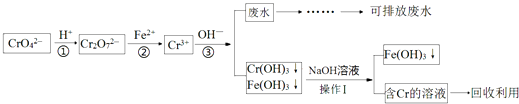
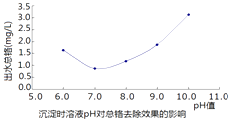
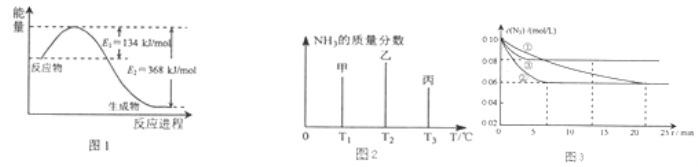
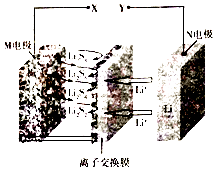
题目内容
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A. 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成Cl2分子数为0. 3 NA
B. 80gSO3在标准状况下所占体积约为22.4L
C. 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,转移的电子的数目为NA
D. 5.4g铝粉与足量的氢氧化钠溶液充分反应生成H2分子数为0. 3 NA
【答案】D
【解析】A、MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,所以0.1L×12mol/L=1.2mol HCl如果完全反应生成Cl2 0.3mol,但是由于反应过程中随着浓盐酸浓度不断降低,反应在HCl没有完全消耗时就不再进行,所以得到的Cl2也就小于0.3mol,HCl分子数小于0.3NA,A错误。B、SO3在标准状态下不是气体,所以本题体积无法计算,B错误。C、因为I-还原性大于Fe2+,所以Fe2+被氧化时,溶液中的I-已经完全被氧化。溶液中有1mol Fe 2+被氧化,则溶液中Fe2+≥1mol,则n(I-)≥2mol,反应过程中转移的电子数等于1×1mol+1×n(I-)≥3mol,C错误。D、足量的NaOH能够将铝粉完全反应,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
MnCl2+Cl2↑+2H2O,所以0.1L×12mol/L=1.2mol HCl如果完全反应生成Cl2 0.3mol,但是由于反应过程中随着浓盐酸浓度不断降低,反应在HCl没有完全消耗时就不再进行,所以得到的Cl2也就小于0.3mol,HCl分子数小于0.3NA,A错误。B、SO3在标准状态下不是气体,所以本题体积无法计算,B错误。C、因为I-还原性大于Fe2+,所以Fe2+被氧化时,溶液中的I-已经完全被氧化。溶液中有1mol Fe 2+被氧化,则溶液中Fe2+≥1mol,则n(I-)≥2mol,反应过程中转移的电子数等于1×1mol+1×n(I-)≥3mol,C错误。D、足量的NaOH能够将铝粉完全反应,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,![]() ,所以生成H2分子数为0.3NA,D正确。正确答案D。
,所以生成H2分子数为0.3NA,D正确。正确答案D。

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示。

(1)将A、E两种元素的元素符号填入下表中正确的位置上。________
族序数 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | ||||||||
三 | ||||||||
(2)A、B、C、D、E、F六种元素中非金属性最强的是____________(填元素符号),B、D两元素可以组成原子个数比为1:1的离子化合物,写出该离子化合物的电子式:______,A、B两元素对应的气态氢化物的稳定性强弱关系是________________(用化学式表示)。
(3)写出D、F两元素的最高价氧化物对应的水化物反应的离子方程式:________________________