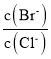题目内容
【题目】探索CO和NO2这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
I.CO可以与H2反应制备合成天然气(SNG)。涉及反应如下:
CO甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)![]() 1=-206.2kJ·mol-1
1=-206.2kJ·mol-1
水煤气变换:CO(g)+H2O(g)CO2(g)+H2(g)![]() 2=-41.2kJ·mol-1
2=-41.2kJ·mol-1
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的![]() =_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
=_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
(2)在恒压管道反应器中将原料气H2和CO按一定比例通入,在催化剂作用下制备合成天然气,400℃、p总为100kPa时反应体系平衡组成如表所示。
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数 | 45.0 | 42.5 | 10.0 | 2.00 | 0.500 |
该条件下CO的总转化率α=______。若将管道反应器升温至500℃,反应达到平衡后CH4的体积分数![]() ______45.0%(填“>”、“<”或“=”)。
______45.0%(填“>”、“<”或“=”)。
II.NO2可发生二聚反应生成N2O4,化学方程式为2NO2![]() N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
(3)已知该反应的正反应速率方程为υ正=k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则右图(lgk表示速率常数的对数;![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随![]() 变化关系的是斜线______,能表示lgk逆随
变化关系的是斜线______,能表示lgk逆随![]() 变化关系的是斜线______。
变化关系的是斜线______。
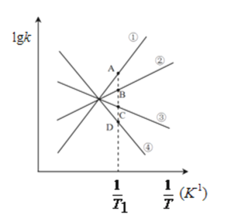
(4)图中A、B、C、D点的纵坐标分别为a+1.5、a+0.5、a-0.5、a-1.5,则T1温度时化学平衡常数K=______mol-1·L。已知T1温度时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol·L-1,此时υ正______υ逆(填>或<);该反应达到平衡后,若将温度从T1升高到T2重新达到平衡,则T1温度时平衡压强p(T1)______T2温度时平衡压强p(T2)(填“>”、“=”或“<”),原因是______。
【答案】-165 B 98.9%或![]() < ③ ④ 10 > < 温度升高体积不变,总压强增大;温度升高平衡左移,体系总物质的量增加,总压强增大
< ③ ④ 10 > < 温度升高体积不变,总压强增大;温度升高平衡左移,体系总物质的量增加,总压强增大
【解析】
I (1)①CO(g)+3H2(g)CH4(g)+H2O(g)△H1=-206.2kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g)△H2=-41.2kJmol-1
将方程式①-②得CO2(g)+4H2(g)CH4(g)+2H2O(g),计算△H;
A为恒温恒容、B为恒温恒压条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,A中压强逐渐减小B中压强不变,所以反应过程中压强A<B,增大压强平衡正向移动;
(2)根据CO甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)反应,设n(H2)=3mol、n(CO)=1mol,恒容恒温条件下气体的体积分数之比等于物质的量分数之比,设平衡时混合气体总物质的量为xmol,根据C原子守恒得(45.0%+2.00%+0.5%)×xmol=1mol,x=![]() ,则CO的转化率=
,则CO的转化率=![]() ×100%;该反应的正反应是放热反应,升高温度平衡逆向移动;
×100%;该反应的正反应是放热反应,升高温度平衡逆向移动;
II(3)化学反应速率与温度成正比,随着温度的降低,![]() 增大,正逆反应速率降低,则lgk正和lgk逆均减小,由于温度降低平衡正向移动,则v正>v逆,则降低相同的温度时lgk逆减小更快,据此分析;
增大,正逆反应速率降低,则lgk正和lgk逆均减小,由于温度降低平衡正向移动,则v正>v逆,则降低相同的温度时lgk逆减小更快,据此分析;
(4)化学平衡常数K=![]() ,平衡时v正=v逆,再利用C点和D点的数据求得k正和k逆;比较浓度熵Qc与K值的大小,若Qc>K则平衡正向移动,若Qc=K则达到平衡,若Qc<K则平衡正向移动;升高温度体系颜色加深,平衡逆向移动,则正反应放热,上述反应达到平衡后,恒容体系,体积不变,升高温度,平衡逆向移动,气体物质的量增大,据此分析。
,平衡时v正=v逆,再利用C点和D点的数据求得k正和k逆;比较浓度熵Qc与K值的大小,若Qc>K则平衡正向移动,若Qc=K则达到平衡,若Qc<K则平衡正向移动;升高温度体系颜色加深,平衡逆向移动,则正反应放热,上述反应达到平衡后,恒容体系,体积不变,升高温度,平衡逆向移动,气体物质的量增大,据此分析。
I (1)①CO(g)+3H2(g)CH4(g)+H2O(g)△H1=-206.2kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g)△H2=-41.2kJmol-1
根据盖斯定律,将方程式①-②得CO2(g)+4H2(g)CH4(g)+2H2O(g),△H=(-206.2+41.2)kJ/mol=-165kJ/mol;A为恒温恒容、B为恒温恒压条件,如果是恒温恒容,反应前后物质的量减小、压强减小,开始时AB压强相等,A中压强逐渐减小B中压强不变,所以反应过程中压强A<B,增大压强平衡正向移动,则B放出的热量多;
(2)根据CO甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)反应,设n(H2)=3mol、n(CO)=1mol,恒容恒温条件下气体的体积分数之比等于物质的量分数之比,设平衡时混合气体总物质的量为xmol,根据C原子守恒得(45.0%+2.00%+0.5%)xmol=1mol,x=![]() ,则CO的转化率=
,则CO的转化率=![]() ×100%=
×100%=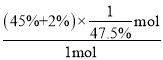 ×100%=
×100%= ![]() ×100%或98.9%;该反应的正反应是放热反应,升高温度平衡逆向移动,则反应迅达到平衡后CH4的体积分数减小,即φ<45%;
×100%或98.9%;该反应的正反应是放热反应,升高温度平衡逆向移动,则反应迅达到平衡后CH4的体积分数减小,即φ<45%;
II(3)化学反应速率与温度成正比,随着温度的降低,![]() 增大,正逆反应速率降低,则lgk正和lgk逆均减小,由于温度降低平衡正向移动,则v正>v逆,则降低相同的温度时lgk逆减小更快,则斜线③表示lgk正随
增大,正逆反应速率降低,则lgk正和lgk逆均减小,由于温度降低平衡正向移动,则v正>v逆,则降低相同的温度时lgk逆减小更快,则斜线③表示lgk正随![]() 变化关系,斜线④能表示lgk逆随
变化关系,斜线④能表示lgk逆随![]() 变化关系;
变化关系;
(4)化学平衡常数K=![]() =
=![]() =10;已知T1温度时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol·L-1,Qc=
=10;已知T1温度时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol·L-1,Qc=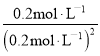 =5<K,则平衡正向移动,v正>v逆;升高温度体系颜色加深,平衡逆向移动,则正反应放热,上述反应达到平衡后,恒容体系,体积不变,升高温度,平衡逆向移动,气体物质的量增大,体系总压强增大,则T1温度时平衡压强p(T1)<T2温度时平衡压强p(T2)。
=5<K,则平衡正向移动,v正>v逆;升高温度体系颜色加深,平衡逆向移动,则正反应放热,上述反应达到平衡后,恒容体系,体积不变,升高温度,平衡逆向移动,气体物质的量增大,体系总压强增大,则T1温度时平衡压强p(T1)<T2温度时平衡压强p(T2)。

 名校课堂系列答案
名校课堂系列答案