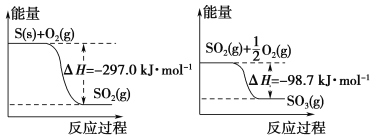
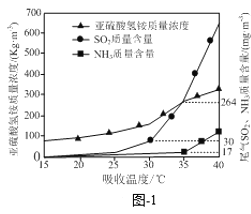
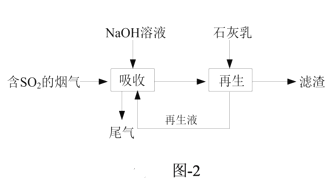
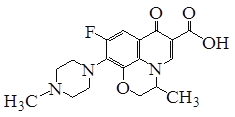题目内容
【题目】2份50mL同样的NaOH的溶液,分别向其中逐渐通入一定量的CO2,得到甲和乙 两种溶液,在甲和乙溶液中分别逐渐加入1mol/LHCl的盐酸溶液,产生的二氧化碳气体(标准状况)与所加入盐酸的体积之间的关系如图所示的关系。
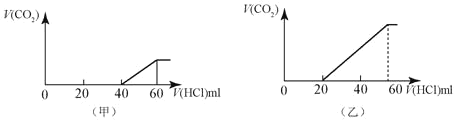
请回答下列问题:
(1)甲溶液中的溶质是____,其物质的量的比值是____。
(2)乙溶液中的溶质是____,其物质的量的比值是____。
【答案】NaOH、Na2CO3 1:1 NaHCO3、Na2CO3 1:1
【解析】
当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑。
(1)甲中生成CO2气体至最大,消耗HCl为20mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为20mL,而图象中开始生成CO2气体时消耗HCl体积为60mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为60mL-20mL-20mL=20mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比;
(2)乙中生成CO2气体至最大,消耗HCl为60mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为40mL,而图象中开始生成CO2气体时消耗HCl体积为20mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3;中和Na2CO3消耗HCl的体积为20mL,根据反应消耗盐酸的体积计算NaHCO3、Na2CO3的物质的量之比。
(1) 甲中生成CO2气体至最大,消耗HCl为20mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为20mL,而图象中开始生成CO2气体时消耗HCl体积为60mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为60mL-20mL-20mL=20mL,由方程式可知NaOH、Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=20mL:20mL=1:1;
故答案为:NaOH、Na2CO3;1:1;
(2) 乙中生成CO2气体至最大,消耗HCl为60mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为40mL,而图象中开始生成CO2气体时消耗HCl体积为20mL,说明该阶段只发生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳与NaOH反应后溶液中含NaHCO3、Na2CO3;中和Na2CO3消耗HCl的体积为20mL,由方程式可知NaHCO3、Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaHCO3、Na2CO3的物质的量之比=20mL:20mL=1:1;
故答案为:NaHCO3、Na2CO3;1:1。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】(1)参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:
温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①该反应正反应是___________(填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________℃。
(2)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
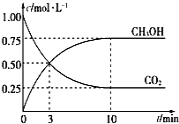
①该反应的平衡常数表达式为K=________;从反应开始到10min,v(H2)=______mol·L-1·min-1;
②下列情况能说明该反应一定达到平衡状态的是___________(填字母)
A.v(CO2)消耗=v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有___________ (填字母)
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度____________(填“>”、“<”或“=”)0.25mol·L-1。