题目内容
【题目】还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
![]()
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到达平衡状态
B. 若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
【答案】B
【解析】试题分析:A.CrO42﹣为黄色的,Cr2O72﹣为橙色的,如果2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)未达到平衡,正向进行,则橙色加深,如果逆向进行则黄色加深。现在溶液颜色保持不变,说明上述可逆反应达到达平衡状态。正确。B. 在1L废水中+6价的Cr的物质的量为n(Cr)=" 28.6g÷" 52g/mol ="0.55mol" .根据氧化还原反应中电子得失数目相等可得。n(FeSO4·7H2O)=3×0.55mol=1.65mol。m(FeSO4·7H2O) = 1.65mol×278g/mol=458.7g.错误。守恒可得0.55mol C. 2CrO42﹣(aq)+2H+(aq)
Cr2O72﹣(aq)+H2O(1)未达到平衡,正向进行,则橙色加深,如果逆向进行则黄色加深。现在溶液颜色保持不变,说明上述可逆反应达到达平衡状态。正确。B. 在1L废水中+6价的Cr的物质的量为n(Cr)=" 28.6g÷" 52g/mol ="0.55mol" .根据氧化还原反应中电子得失数目相等可得。n(FeSO4·7H2O)=3×0.55mol=1.65mol。m(FeSO4·7H2O) = 1.65mol×278g/mol=458.7g.错误。守恒可得0.55mol C. 2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)的平衡常数为
Cr2O72﹣(aq)+H2O(1)的平衡常数为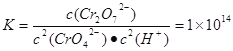 c(CrO42-)="{(28.6÷52)÷11}mol/L=0.05mol/L," c(Cr2O72-)=(11÷2)×c(CrO42-)=0.25mol/L,代入该平衡常数表达式中可得c(H+)=10-6mol/L.所以pH=6.正确。D. c(Cr3+)·c3(OH-)=1×10﹣32. c3(OH-)=1×10﹣32÷1×10﹣5=1×10﹣27.所以c(OH-)=1×10﹣9.c(H+)=1×10﹣14÷1×10﹣9=1×10﹣5. pH=5.正确.
c(CrO42-)="{(28.6÷52)÷11}mol/L=0.05mol/L," c(Cr2O72-)=(11÷2)×c(CrO42-)=0.25mol/L,代入该平衡常数表达式中可得c(H+)=10-6mol/L.所以pH=6.正确。D. c(Cr3+)·c3(OH-)=1×10﹣32. c3(OH-)=1×10﹣32÷1×10﹣5=1×10﹣27.所以c(OH-)=1×10﹣9.c(H+)=1×10﹣14÷1×10﹣9=1×10﹣5. pH=5.正确.