题目内容
【题目】硫酸常用于金属表面除锈.(原理:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O)
(1)把50g质量分数为98%的浓硫酸,稀释成10%的稀硫酸,需要水的质量是多少?
(2)要使16gFe2O3恰好完全反应,需消耗上述10%的稀硫酸的质量是多少?
【答案】
(1)解:溶液稀释前后溶质的质量不变,设需水的质量为x,则有50g×98%=(50g+x)×10%,解得x=440g;
答:需要水的质量是440g;
(2)解:设需10%的稀硫酸的质量是y
Fe2O3+ | 3H2SO4 | ═ | Fe2(SO4)3+ | 3H2O |
160 | 294 | |||
16g | y×10% |
![]() =
= ![]()
解得:y=294g
答:要使16g Fe2O3恰好完全反应,需消耗上述10%的稀硫酸的质量294g.
【解析】(1)溶液稀释前后溶质的质量不变,据此分析解答;(2)据Fe2O3的质量和反应的方程式、溶质的质量=溶液的质量×溶质的质量分数,可计算出反应的稀硫酸的质量.

【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g·mL﹣1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1) 加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是 混合液体时最后加入浓硫酸的理由: 。
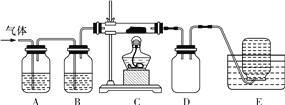
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点最好采用装置 (填“甲”或“乙”或“丙”)。

Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称,操作Ⅱ 。

(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是 。
(6)列式计算,苯甲酸甲酯的产率是 。