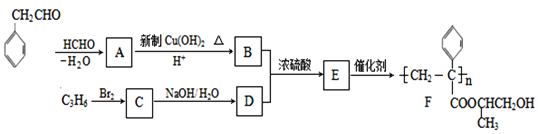
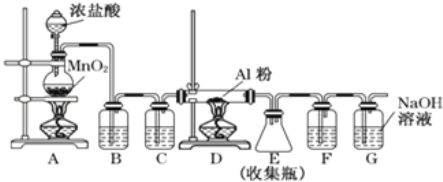
题目内容
【题目】下面是几种有机化合物的转换关系:
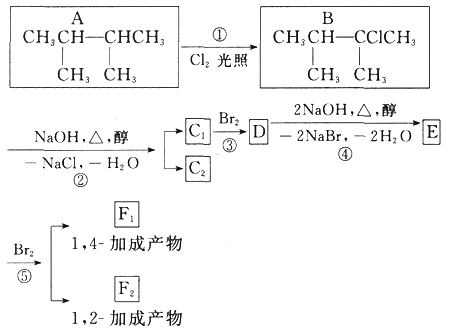
请回答下列问题:
(1)根据系统命名法,化合物A的名称是_____。
(2)上图反应中(填反应类型),①是_____反应,③是_____反应。
(3)E是重要的化工原料,写出由D生成E的化学方程式:_____。
(4)C1的结构简式是_____。
(5)写出符合下列条件的A的同分异构体的结构简式_____。
①含支链 ②核磁共振氢谱有3个峰
【答案】 2,3-二甲基丁烷 取代 加成 ![]()
![]()
![]()
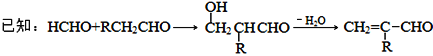
【解析】烷烃A与氯气发生取代反应生成卤代烃B,B发生消去反应生成C1、C2,C2与溴发生加成反应生成二溴代物D,D再发生消去反应生成E,E与溴可以发生1,2-加成或1,4-加成,故C2为![]() ,C1为
,C1为![]() ,则D为
,则D为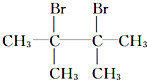 ,E为
,E为![]() ,F1为
,F1为 ,F2为
,F2为 。
。
(1)根据系统命名法,化合物A的名称是:2,3-二甲基丁烷,故答案为:2,3-二甲基丁烷;
(2)上述反应中,反应①中A中H原子被Cl原子确定生成B,属于取代反应,反应③是碳碳双键与溴发生加成反应是,故答案为:取代反应;加成反应;
(3)由D生成E是卤代烃发生消去反应,该反应的化学方程式为: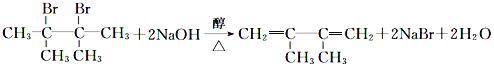 ,故答案为:
,故答案为: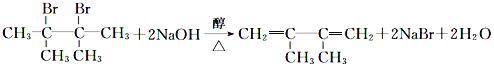 ;
;
(4)由上述分析可知,C1的结构简式是![]() ,故答案为:
,故答案为:![]() ;
;
(5)A为![]() ,①含支链;②核磁共振氢谱有3个峰,满足条件的A的同分异构体有
,①含支链;②核磁共振氢谱有3个峰,满足条件的A的同分异构体有![]() :故答案为:
:故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下表是甲、乙、丙、丁、戊五种有机物的有关信息:
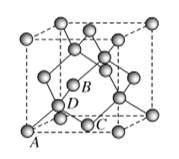
甲 | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
乙 | ①由C、H两种元素组成;②球棍模型为 |
丙 | ①由C、H、O三种元素组成;②能与Na反应,但不能与 |
丁 | ①相对分子质量比丙少;②能由丙氧化而成 |
戊 | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应所得产物的名称是___________________。
(2)甲与氢气发生加成反应后生成物质己,在己在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式![]() 。当n=___________________时,这类有机物开始出现同分异构体。
。当n=___________________时,这类有机物开始出现同分异构体。
(3)乙具有的性质是___________________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性![]() 溶液和溴水反应而使其褪色
溶液和溴水反应而使其褪色
(4)丙与戊反应能生成相对分子质量为100的酯,所发生反应的反应类型为_____________________,对应的化学方程式为_______________________。
(5)写出丙氧化生成丁的化学反应方程式:__________________________________________。