题目内容
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:
①取一定量的该烃,使其充分燃烧后的气体通过装有CaCl2干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g。
②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
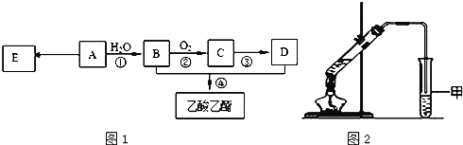
(1)0.1mol该烃A能与 _____g溴发生加成反应;加成产物需 _____mol溴蒸气完全取代;
(2)B中官能团的名称是_____, B可通过加入强氧化剂为_______(任填一种)一步直接氧化为D。
(3)E是常见的高分子材料,写出E的结构简式______;合成E的反应类型______;
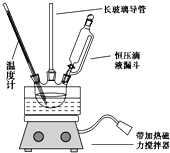
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________;
②上述实验中饱和碳酸钠溶液的作用是________;
③在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是_____。
(5)比乙酸乙酯相对分子质量大14的酯有_____种结构。
【答案】16 0.4 羟基 酸性高锰酸钾溶液或者酸性重铬酸钾溶液 ![]() 加聚反应 防倒吸 中和乙酸,吸收乙醇,降低乙酸乙酯的溶解度,便于分层析出 该反应为可逆反应,不可能完全转化 9种
加聚反应 防倒吸 中和乙酸,吸收乙醇,降低乙酸乙酯的溶解度,便于分层析出 该反应为可逆反应,不可能完全转化 9种
【解析】
(1)由题干信息可知,A的摩尔质量为1.25g·L-1×22.4L/mol=28g/mol,取一定量的该烃,使其充分燃烧后的气体通过装有CaCl2干燥管,干燥管增重7.2g,则水的质量为为7.2g,n(H)=7.2g÷18g/mol×2=0.8mol,再通过石灰水,石灰水增重17.6g,说明二氧化碳的质量为17.6g,n(C)=17.6g÷44g/mol=0.4mol,则C原子与H原子的个数比为1:2,说明A为乙烯,A中含有碳碳双键,0.1mol乙烯能和0.1mol溴发生加成反应,0.1mol溴的质量为16g,1,2二溴乙烷能和溴发生取代反应,且H原子和溴分子的物质的量之比为1:1,0.1mol的1,2二溴乙烷中含有0.4molH原子,所以需要0.4mol溴与其发生完全取代反应,故答案为:16,0.4;
(2)乙烯与水发生加成反应生成的B物质为乙醇,它的官能团为羟基,乙醇可与强氧化剂高锰酸钾或者酸性重铬酸钾溶液反应直接得到乙酸,故答案为:羟基、酸性高锰酸钾溶液或者酸性重铬酸钾溶液;
(3)E是常见的高分子材料,则E是聚乙烯,它的结构简式为:[CH2—CH2]n,乙烯通过加聚反应生成聚乙烯,故答案为:[CH2—CH2]n、加聚反应;
(4)实验结束后,试管甲中上层为透明的、不溶于水的油状液体为乙酸乙酯,
①实验开始时,试管甲中的导管不伸入液面下的原因是防止倒吸;
②饱和碳酸钠溶液能与未反应的乙酸反应,溶解挥发出的乙醇,且乙酸乙酯在饱和碳酸钠溶液中溶解度最小,从而促进乙酸乙酯析出,故答案为:中和乙酸,吸收乙醇,降低乙酸乙酯的溶解度,便于分层析出;
③由于乙酸与乙醇反应生成乙酸乙酯和水的反应是可逆反应,化学反应具有一定限度,不能达到完全转化,故答案为:该反应为可逆反应,不可能完全转化;
(5)比乙酸乙酯相对分子质量大14的酯,即分子组成上多一个CH2原子团,所以比乙酸乙酯相对分子质量大14的酯有乙酸丙酯2种,丙酸乙酯1种,丁酸甲酯2种,甲酸丁酯4种,共9种结构,故答案为:9种。

 阶梯计算系列答案
阶梯计算系列答案【题目】A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g)![]() cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表。下列说法正确的是
cC(g)+dD(g),t1、t2时刻分别测得部分数据如下表。下列说法正确的是
n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min |
0.12 | 0.06 | 0.10 | t1 |
0.06 | 0.12 | 0.20 | t2 |
A. 0~t1时间段内,平均反应速率v(B)=0.04/t1 mol·(L·min)-1
B. 若起始时n(D)=0,则t2时刻v(D)=0.20/t2 mol·(L·min)-1
C. 升高温度,v(B)、v(C)、v(D)均增大
D. b∶d=6∶1