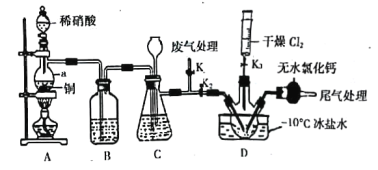
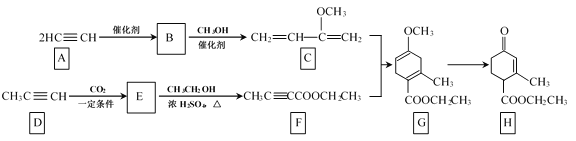
��Ŀ����
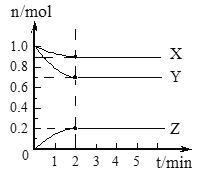
����Ŀ�����淴ӦA��g��+3B��g��2C��g�� ��H=��Q kJ/mol���мס��������ݻ���ͬ�Ҳ�����ܱ���������������м���1molA��3molB����һ�������´ﵽƽ��ʱ�ų�����ΪQ1 kJ������ͬ�������£����������м���2mol C�ﵽƽ�����������ΪQ2kJ����֪Q1=4Q2��������������ȷ���ǣ�������
A. ����C��ת����Ϊ20%
B. Q1+Q2=Q
C. �ﵽƽ����������м���0.2 molA��0.6molB��1.6molC��ƽ��������Ӧ�����ƶ�
D. ���е��Ȼ�ѧ��Ӧ����ʽΪ2C��g��A��g��+3B��g�� ��H=+4Q2kJmol��1
���𰸡�D
��������
��Q1=4Q2����֪��n��(A)=4��n��(A)������дﵽƽ��ʱת����xmolA������n��(A)=![]() mol��
mol��
�� A(g)+3B(g)2C(g)
��ʼ(mol)�� 1 3 0
ת��(mol)�� x 3x 2x
ƽ��(mol)��1-x 3-3x 2x
�� A(g)+3B(g)2C(g)
��ʼ(mol)��0 0 2
ת��(mol)��![]()
![]() x
x ![]() x
x
ƽ��(mol)��![]()
![]() x 2-
x 2-![]() x
x
������һ�ߵ���������֪��1 mol A��3 mol B������2 mol C���ǵ�Ч���ϣ�������ͬ��ͬ�ݵ������½�����ƽ��״̬��ȫ��ͬ����1-x=![]() ��x=0.8��
��x=0.8��
A���������п�ʼ����1molA�ĺ�3molB���������п�ʼ����2mol CΪ��ȫ��Чƽ�⣬ƽ��ʱ��ͬ��ֵ����ʵ�����ȣ�������C��ת����=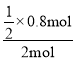 ��100%=20%����A��ȷ��
��100%=20%����A��ȷ��
B���������п�ʼ����1molA�ĺ�3molB���������п�ʼ����2mol CΪ��ȫ��Чƽ�⣬�״ﵽƽ��ʱ�ų�����ΪQ1 kJ������ͬ�������£��Ҵﵽƽ�����������ΪQ2kJ������Q=Q1+Q2����B��ȷ��
C��������һ�ߵ���������֪�ټ�����0.2 mol A��0.6 mol B��1.6 mol C�����ټ�����2 mol C����Ч���ں��º��������£��൱������ѹǿ��ƽ��������C�ķ����ƶ�����C��ȷ��
D��A(g)+3B(g)2C(g) ��H=��Q kJ/mol����2C(g)A(g)+3B(g) ��H=+QkJmol��1����ΪQ=Q1 +Q2=4Q2+Q2=5Q2�������H=+5Q2kJmol��1����D����
��ѡD��

 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�����Ŀ�����ж��й���ʵ��������ȷ����
ѡ�� | ��ʵ���� | ���֪ʶ���� |
A | ������´�����ȶѡ����������ׯ���� | ��Ȼ�̵���N2+2O2 |
B | ��������ˮʯ���� | ����CaCO3+CO2+H2O=Ca(HCO3)2 |
C | ��ľ�ݾ���ע��������ǿ��֮������������������ʯҲ���� | ����ʯ��ΪKNO3����Ԫ�ص���ɫ��ӦΪ��ɫ |
D | Ұ��֮���ף����ɫ�࣬��״��棬��ۻ�ɢ���׳ƹ���ʵ����Ѫ֮��Ҳ�� | ���⡱��ָ����(PH3)��ȼ������ѧ��ת��Ϊ���� |
A.AB.BC.CD.D