Ő‚ńŅńŕ»›
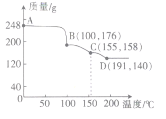
°ĺŐ‚ńŅ°Ņ(I)ń≥ő¬∂» Ī£¨‘ŕ2 LĶń»›∆ų÷–£¨X°ĘY°ĘZ»ż÷÷∆ÝŐŚĶńőÔ÷ ĶńŃŅňś ĪľšĶńĪšĽĮ«ķŌŖ»ÁÕľňý ĺ°£«ŽÕ®Ļżľ∆ň„ĽōīūŌ¬Ń–ő Ő‚°£
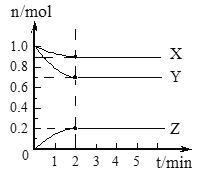
(1)Ń– Ĺľ∆ň„∑ī”¶Ņ™ ľ÷Ń2 min£¨YĶń∆Ĺĺý∑ī”¶ňŔ¬ ___________°£
(2)∑÷őŲ”–Ļō żĺ›£¨–ī≥ŲX°ĘY°ĘZĶń∑ī”¶∑Ĺ≥Ő Ĺ___________°£
(3)”…Õľ÷–Ņī≥Ų£ļ________∑÷÷”ļů£¨A°ĘB°ĘCłųőÔ÷ ĶńőÔ÷ ĶńŃŅ≤Ľ‘Ŕňś Īľš∂ÝĪšĽĮ£¨ňĶ√ų‘ŕ’‚łŲŐűľĢŌ¬£¨ł√∑ī”¶“—īÔĶĹŃň________________◊īŐ¨°£
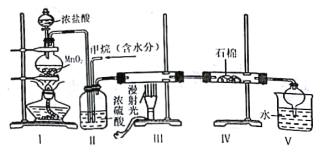
(II)ĹęīŅ–Ņ∆¨ļÕīŅÕ≠∆¨įī»ÁÕľňý ĺ∑Ĺ Ĺ≤Ś»Ž100 mLŌŗÕ¨Ň®∂»ĶńŌ°ŃÚňŠ÷–“Ľ∂ő Īľš£¨ĽōīūŌ¬Ń–ő Ő‚£ļ
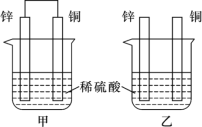
ĘŔŌ¬Ń–ňĶ∑®’ż»∑Ķń «____________(ŐÓ◊÷ńłīķļŇ)°£
A£ģľ◊°Ę““ĺýő™ĽĮ—ßń‹◊™Īšő™ĶÁń‹Ķń◊į÷√
B£ģ““÷–Õ≠∆¨…Ō√Ľ”–√ųŌ‘ĪšĽĮ
C£ģľ◊÷–Õ≠∆¨÷ ŃŅľű…Ŕ°Ę““÷––Ņ∆¨÷ ŃŅľű…Ŕ
D£ģŃĹ…’Ī≠÷–»‹“ļĶńpHĺý‘Ųīů
Ęŕ‘ŕŌŗÕ¨ Īľšńŕ£¨ŃĹ…’Ī≠÷–≤ķ…ķ∆ÝŇ›ĶńňŔ∂»£ļľ◊____““(ŐÓ°į£ĺ°Ī°Ę°į£ľ°įĽÚ°į£Ĺ°Ī)°£
ĘŘ«Ž–ī≥ŲÕľ÷–ĻĻ≥…‘≠ĶÁ≥ōĶń◊į÷√’żľęĶńĶÁľę∑ī”¶ Ĺ______________________°£
°ĺīūįł°Ņ0.075 mol(L min)-1 v (X): v (Y): v (Z) =°ųn(X):°ųn(Y):°ųn(Z)=0.1mol:0.3mol:0.2mol=1:3:2
∑ī”¶∑Ĺ≥Ő Ĺ «£ļX(g)+3Y(g)2Z(g) 2 ł√ŐűľĢŌ¬ĶńĽĮ—ß∆Ĺļ‚(ĽÚĽĮ—ß∑ī”¶Ōř∂») BD £ĺ 2H+ +2e£≠= H2°Ł
°ĺĹ‚őŲ°Ņ
(I)(1)łýĺ›∆Ĺĺý∑ī”¶ňŔ¬ =![]() ľ∆ň„£Ľ(2)łýĺ›Õľ÷™£¨∑ī”¶őÔ «X°ĘY£¨…ķ≥…őÔ «Z£¨Õ¨“ĽŅ…ńś∑ī”¶÷–Õ¨“Ľ∂ő Īľšńŕ£¨łųőÔ÷ ĶńőÔ÷ ĶńŃŅĪšĽĮŃŅ÷ģĪ»Ķ»”ŕ∆šľ∆ŃŅ ż÷ģĪ»£Ľ(3)∑ī”¶īÔĶĹ∆Ĺļ‚◊īŐ¨ Ī£¨łųőÔ÷ ĶńőÔ÷ ĶńŃŅ≤ĽĪš°£
ľ∆ň„£Ľ(2)łýĺ›Õľ÷™£¨∑ī”¶őÔ «X°ĘY£¨…ķ≥…őÔ «Z£¨Õ¨“ĽŅ…ńś∑ī”¶÷–Õ¨“Ľ∂ő Īľšńŕ£¨łųőÔ÷ ĶńőÔ÷ ĶńŃŅĪšĽĮŃŅ÷ģĪ»Ķ»”ŕ∆šľ∆ŃŅ ż÷ģĪ»£Ľ(3)∑ī”¶īÔĶĹ∆Ĺļ‚◊īŐ¨ Ī£¨łųőÔ÷ ĶńőÔ÷ ĶńŃŅ≤ĽĪš°£
(II)ľ◊£ļ‘≠ĶÁ≥ō÷–ĹŌĽÓ∆√Ķń–Ņ◊ųłļľę£ļZn -2e£≠= Zn2+£¨Õ≠◊ų’żľę£ļ2H+ +2e£≠= H2°Ł£¨Õ≠ĶÁľę…Ō≤ķ…ķ∆ÝŇ›£Ľ““÷–£ļ≤Ľń‹–ő≥…‘≠ĶÁ≥ō£¨ «–Ņ”ŽŃÚňŠ÷ĪĹ”∑ī”¶£¨‘ŕ–Ņ∆¨…Ō≤ķ…ķ∆ÝŇ›°£
(I)(1)∑ī”¶Ņ™ ľ÷Ń2min£¨YĶń∆Ĺĺý∑ī”¶ňŔ¬ =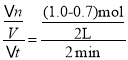 mol(L min)-1=0.075mol(L min)-1£¨Ļ īūįłő™£ļ0.075mol(L min)-1£Ľ
mol(L min)-1=0.075mol(L min)-1£¨Ļ īūįłő™£ļ0.075mol(L min)-1£Ľ
(2)łýĺ›Õľ÷™£¨∑ī”¶őÔ «X°ĘY£¨…ķ≥…őÔ «Z£¨īÔĶĹ∆Ĺļ‚ Ī°ųn£®X£©=£®1.0-0.9£©mol=0.1mol°Ę°ųn£®Y£©=£®1.0-0.7£©mol=0.3mol°Ę°ųn£®Z£©=£®0.2-0£©mol=0.2mol£¨Õ¨“ĽŅ…ńś∑ī”¶÷–Õ¨“Ľ∂ő Īľšńŕ£¨łųőÔ÷ ĶńőÔ÷ ĶńŃŅĪšĽĮŃŅ÷ģĪ»Ķ»”ŕ∆šľ∆ŃŅ ż÷ģĪ»£¨‘ÚX°ĘY°ĘZĶńľ∆ŃŅ ż÷ģĪ»=0.1mol£ļ0.3mol°Ę0.2mol=1£ļ3£ļ2£¨ňý“‘ł√∑ī”¶∑Ĺ≥Ő Ĺő™X(g)+3Y(g)2Z(g)£¨Ļ īūįłő™£ļX(g)+3Y(g)2Z(g)£Ľ
(3)”…Õľ÷–Ņī≥Ų£ļ2∑÷÷”ļů£¨A°ĘB°ĘCłųőÔ÷ ĶńőÔ÷ ĶńŃŅ≤Ľ‘Ŕňś Īľš∂ÝĪšĽĮ£¨ňĶ√ų‘ŕ’‚łŲŐűľĢŌ¬£¨ł√∑ī”¶“—īÔĶĹŃňł√ŐűľĢŌ¬ĶńĽĮ—ß∆Ĺļ‚(ĽÚĽĮ—ß∑ī”¶Ōř∂»)◊īŐ¨°£Ļ īūįłő™£ļ2£Ľł√ŐűľĢŌ¬ĶńĽĮ—ß∆Ĺļ‚(ĽÚĽĮ—ß∑ī”¶Ōř∂»)£Ľ
(II)ĘŔA£ģľ◊ő™ĽĮ—ßń‹◊™Īšő™ĶÁń‹Ķń◊į÷√£¨““÷–≤Ľ–ő≥…ĶÁŃų£¨Ļ AīŪőů£Ľ
B£ģ““÷–Õ≠∆¨…Ō√Ľ”–√ųŌ‘ĪšĽĮ£¨–Ņ∆¨»‹Ĺ‚£¨≤Ę‘ŕ–Ņ∆¨…Ō≤ķ…ķ∆ÝŇ›£¨Ļ B’ż»∑£Ľ
C£ģľ◊÷––Ņ∆¨÷ ŃŅľű…Ŕ£¨Õ≠∆¨÷ ŃŅ≤ĽĪš£Ľ““÷––Ņ∆¨÷ ŃŅľű…Ŕ£¨Õ≠∆¨÷ ŃŅ“≤≤ĽĪš£¨Ļ CīŪőů£Ľ
D£ģŃĹ…’Ī≠÷–ĺý∑Ę…ķZn£ę2H£ę=Zn2£ę£ęH2°Ł£¨H£ęŇ®∂»ľű–°£¨»‹“ļĶńpHĺý‘Ųīů£¨Ļ D’ż»∑£Ľ
Ļ īūįłő™£ļBD£Ľ
Ęŕľ◊÷––ő≥…‘≠ĶÁ≥ō£¨ľ”Ņž∑ī”¶ňŔ¬ £¨‘ŕŌŗÕ¨ Īľšńŕ£¨ŃĹ…’Ī≠÷–≤ķ…ķ∆ÝŇ›ĶńňŔ∂»£ļľ◊£ĺ““°£Ļ īūįłő™£ļ£ĺ£Ľ
ĘŘ’żľę…Ō«‚ņŽ◊”Ķ√ĶÁ◊”…ķ≥…«‚∆Ý£¨’żľęĶńĶÁľę∑ī”¶ Ĺ2H+ +2e£≠= H2°Ł°£Ļ īūįłő™£ļ2H+ +2e£≠= H2°Ł°£

°ĺŐ‚ńŅ°ŅN2Oň◊√Żő™°į–¶∆Ý°Ī£¨“≤ «“Ľ÷÷ő¬ “∆ÝŐŚ°£ĹŠļŌňý—ß÷™ ∂£¨ĽōīūŌ¬Ń–ő Ő‚£ļ
(1)–Ņ”ŽľęŌ°ŌűňŠ∑ī”¶Ņ……ķ≥…N2O£¨ł√∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺő™___________£¨∆š÷–◊ų—űĽĮľŃĶńŌűňŠ”Ž≤ő”Ž∑ī”¶ĶńŌűňŠĶńőÔ÷ ĶńŃŅ÷ģĪ»ő™___________°£
(2)“—÷™ľł÷÷őÔ÷ ĶńŌŗ∂‘ń‹ŃŅ»ÁŌ¬£ļ
őÔ÷ | N2O(g) | CO(g) | N2(g) | CO2(g) |
Ōŗ∂‘ń‹ŃŅ/kJmol-1 | 475.5 | 283.0 | 393.5 | 0 |
ĘŔN2O(g)ļÕCO(g)∑ī”¶…ķ≥…N2(g)ļÕCO2(g)Ķń»»ĽĮ—ß∑Ĺ≥Ő Ĺő™____________°£
Ęŕ»Ű∆šňŻŐűľĢ≤ĽĪš£¨ľ”»ŽłŖ–ßīŖĽĮľŃ£¨ł√∑ī”¶Ķńž ĪšĹę_______(ŐÓ°į‘Ųīů°Ī°Ę°įľű–°°ĪĽÚ°į≤ĽĪš°Ī)°£
(3)Ķ‚’Ű∆Ýń‹īŖĽĮN2OĶń∑÷Ĺ‚£¨∑ī”¶ņķ≥Ő(≤Ĺ÷Ť)»ÁŌ¬£ļ
i.I2(g)2I(g)
ii.I(g)£ęN2O(g)£ĹN2(g)£ęIO(g)
iii.2IO(g)£ę2N2O(g)£Ĺ2N2(g)£ę2O2(g)£ęI2(g)
Ķ—ťĪŪ√ų£¨‘ŕ∑ī”¶Ļż≥Őc(I) ľ÷’īů”ŕc(IO)£¨”…īňÕ∆≤‚£¨∑ī”¶ňŔ¬ ii_________iii(ŐÓ°į>°Ī°Ę°į<°ĪĽÚ°į£Ĺ°Ī)°£
(4)“Ľ∂®ő¬∂»Ō¬£¨ŌÚļ„»›√‹Ī’»›∆ų÷–≥š»Ž2 mol N2O(g)ļÕ3 mol NO(g)£¨∑Ę…ķ∑ī”¶£ļN2O(g)£ęNO(g)N2(g)£ęNO2(g) °ųH°£≤‚Ķ√N2ŐŚĽż∑÷ ż”Žő¬∂»°Ę ĪľšĶńĻōŌĶ»ÁÕľňý ĺ°£
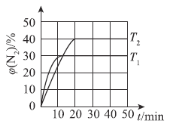
ĘŔ°ųH___________0(ŐÓ°į>°Ī°Ę°į<°ĪĽÚ°į£Ĺ°Ī)°£
ĘŕŌ¬Ń–«ťŅŲĪŪ√ųł√∑ī”¶īÔĶĹ∆Ĺļ‚◊īŐ¨Ķń «___________(ŐÓ◊÷ńł)°£
A.ĽžļŌ∆ÝŐŚĶń√‹∂»≤Ľ‘ŔłńĪš B.Ōŗ∂‘∑÷◊”÷ ŃŅ≤Ľ‘ŔłńĪš
C.NOļÕNO2ĶńŌŻļńňŔ¬ ŌŗĶ» D.N2OĶńŐŚĽż∑÷ ż≤Ľ‘ŔłńĪš
ĘŘT1 Ī£¨ł√∑ī”¶Ķń∆Ĺļ‚≥£ żK£Ĺ___________°£
°ĺŐ‚ńŅ°ŅŌ¬Ń– Ķ—ťĶńŌ÷Ōů”Ž∂‘”¶ĹŠ¬Řĺý’ż»∑Ķń «
—°ŌÓ | ≤Ŕ◊ų | Ō÷Ōů | ĹŠ¬Ř |
A | ≥£ő¬Ō¬ĹęAl∆¨∑Ň»ŽŇ®ŌűňŠ÷– | őř√ųŌ‘ĪšĽĮ | Al”ŽŇ®ŌűňŠ≤Ľ∑ī”¶ |
B | ŌÚń≥»‹“ļ÷–÷ūĶőľ”»Ž—őňŠ | ≤ķ…ķőř…ęőřő∂∆ÝŐŚ | īň»‹“ļ÷–ļ¨”– |
C | ŌÚń≥»‹“ļ÷–Ķőľ”Ō°NaOH»‹“ļ£¨Ĺę ™»ůĶńļž…ę Į»Ô ‘÷Ĺ÷√”ŕ ‘Ļ‹Ņŕ | ‘÷Ĺ≤ĽĪšņ∂ | ‘≠»‹“ļ÷–őř |
D | Ō»ŌÚń≥»‹“ļ÷–÷ūĶőľ”»Ž¬»ĽĮĪĶ»‹“ļ£¨‘Ŕľ”Ō°ŌűňŠ | ”–į◊…ę≥ŃĶŪ≤ķ…ķ£¨«“≥ŃĶŪ≤Ľ»‹Ĺ‚ | īň»‹“ļ÷–“Ľ∂®ļ¨”– |
A.AB.BC.CD.D