题目内容
4.向硝酸钡溶液逐渐通入二氧化硫气体,可能发生的离子方程式如下,其中错误的是( )| A. | 3SO2+2NO3-+2H2O═2NO↑+4H++3SO42- | |
| B. | 3SO2+Ba2++2NO3-+2H2O═BaSO4↓+2NO↑+4H++SO42- | |
| C. | 6SO2+Ba2++4NO3-+4H2O═BaSO4↓+4NO↑+8H++5SO42- | |
| D. | 3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+ |
分析 硝酸根离子在酸性条件下能够将二氧化硫氧化成硫酸根离子,当硝酸钡足量时,所有的二氧化硫都转化成硫酸钡沉淀,反应的离子方程式为:3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+;当二氧化硫足量时,所有的硝酸钡电离出的硝酸根离子都完全反应,硫酸根离子有剩余,反应的离子方程式为:3SO2+Ba2++2NO3-+2H2O═BaSO4↓+2NO↑+4H++2SO42-,据此进行判断.
解答 解:硝酸根离子在酸性条件下能够将二氧化硫氧化成硫酸根离子,当硝酸钡足量时,所有的二氧化硫都转化成硫酸钡沉淀,反应的离子方程式为:3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+;当二氧化硫足量时,所有的硝酸钡电离出的硝酸根离子都完全反应,硫酸根离子有剩余,反应的离子方程式为:3SO2+Ba2++2NO3-+2H2O═BaSO4↓+2NO↑+4H++2SO42-,
A.反应中一定有硫酸钡沉淀生成,故A错误;
B.当二氧化硫足量时发生反应:3SO2+Ba2++2NO3-+2H2O═BaSO4↓+2NO↑+4H++SO42-,故B正确;
C.硝酸钡中钡离子与硝酸根离子的物质的量之比为1:2,该反应中不满足硝酸钡的化学式组成,故C错误;
D.当二氧化硫不足时,所有的硫酸根离子都转化成硫酸钡沉淀,反应的离子方程式为:3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+,故D正确;
故选AC.
点评 本题考查了离子方程式的书写及判断,题目难度中等,侧重考查反应物过量情况对生成物的影响,明确发生反应的实质为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
12. 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置及有关数据列表如下:
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是B(填正确选项前的字母)
A.引发反应 B.减少副产物 C.防止乙醇挥发
(2)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母)
A.饱和碳酸氢钠溶液 B.浓硫酸 C.氢氧化钠溶液
(3)判断装置D中该制备反应已经结束的最简单方法是观察溴水颜色是否褪尽
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”)
(5)若产物中有少量副产物乙醚,除去乙醚的方法是蒸馏(填实验操作方法)
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置及有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是B(填正确选项前的字母)
A.引发反应 B.减少副产物 C.防止乙醇挥发
(2)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母)
A.饱和碳酸氢钠溶液 B.浓硫酸 C.氢氧化钠溶液
(3)判断装置D中该制备反应已经结束的最简单方法是观察溴水颜色是否褪尽
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”或“下”)
(5)若产物中有少量副产物乙醚,除去乙醚的方法是蒸馏(填实验操作方法)
19.有关电解质的说法正确的是( )
| A. | 纯水的导电性很差,所以水不是电解质 | |
| B. | SO3水溶液的导电性很好,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
9.对于碳原子数小于或等于6的烃,下列说法中正确的是( )
| A. | 6个碳原子形成的烃分子中,最多有5个C-C单键 | |
| B. | C2H4的结构简式可表示为CH2CH2 | |
| C. | C3H6分子中一定含有C═C双键 | |
| D. | C6H6分子中,所有原子均可能在同一平面内 |
16.按要求回答下列问题:
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL 3mol•L-1的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(2)常温下,向一定体积的0.1mol•L-1的醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中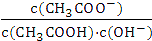 不变 D.溶液中
不变 D.溶液中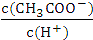 减小
减小
(3)常温下将0.15mol•L-1的稀硫酸V1mL与0.1mol•L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积的变化忽略不计).
(4)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如表所示:
①根据表中数据,将浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最小的是A.
A.HCNB.HClO C.H2CO3D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+和Fe2+的溶液中滴加NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[Mg(OH)2](填“>”“=”或“<”).
(1)实验室中通常用NaOH溶液进行洗气和提纯,当用100mL 3mol•L-1的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(2)常温下,向一定体积的0.1mol•L-1的醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中
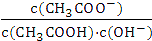 不变 D.溶液中
不变 D.溶液中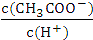 减小
减小(3)常温下将0.15mol•L-1的稀硫酸V1mL与0.1mol•L-1的NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积的变化忽略不计).
(4)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCNB.HClO C.H2CO3D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.NaHCO3+HCN=NaCN+H2O+CO2↑
(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
14.在298K时,实验测得溶液中的反应H2O2+2HI═2H2O+I2在不同浓度时的化学反应速率见表:
反应H2O2+2HI═2H2O+I2在不同浓度时的化学反应速率
(1)请找出化学反应速率与H2O2浓度及HI浓度之间的关系,相应的数学表达式为Kc(HI)c(H2O2),
(2)上式表达式中κ称为速率常数,通常情况下,κ越大,反应进行的越快.
反应H2O2+2HI═2H2O+I2在不同浓度时的化学反应速率
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol•L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol•L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| ν(HI)/mol•L-1•s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
(2)上式表达式中κ称为速率常数,通常情况下,κ越大,反应进行的越快.
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: