题目内容
13.(1)实验室制取氢氧化铁胶体的实验操作是向沸腾的水中滴加少量氯化铁饱和溶液,并继续煮沸至液体呈红褐色,可用丁达尔效应(方法)证明胶体已经制成.(2)现有以下物质:①NaCl晶体 ②干冰 ③稀醋酸 ④汞 ⑤蔗糖(C12H22O11) ⑥冰醋酸请回答下列问题(用序号):以上物质中能导电的是③④;以上物质中属于电解质的是①⑥.
(3)已知:2Fe3++2I-=2Fe2++I2; 2Fe2++Br2=2Fe3++2Br-
①向含有1mol FeI2和1.5mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是I-、Fe2+.
②如果向①的溶液中通入3mol Cl2,则被氧化的离子对应的氧化产物分别是Fe3+、I2、Br2.
(4)①若m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m:n=1:2.7,该反应的化学方程式为5Fe+12HNO3=5Fe(NO3)2+N2↑+6H2O(假设还原产物只有一种,且只生成一种盐).
②若含 n g HNO3的稀硝酸溶液恰好使5.6g铁粉完全溶解,若有 n/4gHNO3被还原成NO(无其它还原产物)则 n 的范围为16.8g≤n≤25.2g.
③某条件下锌和硝酸反应时的物质的量之比为2:5,此时硝酸的还原产物是N2O或NH4NO3.
分析 (1)将饱和三氯化铁溶液滴人沸水中来制取氢氧化铁胶体,胶体具有丁达尔效应;
(2)电解质是在熔融状态或水溶液中能导电的化合物,电解质在熔融状态下或水溶液中能导电,金属单质和半导体材料能导电;
(3)通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,通入氯气的量为1~2mol的过程中,亚铁离子从2.5mol降到0.5mol,三价铁的量逐渐增大,此时氯气消耗完毕;如果向①的溶液中通入3mol Cl2,则被氧化的离子还有溴离子,据此回答;
(4)①根据Fe与硝酸的质量之比求出,其物质的量之比,根据电子守恒求出反应产物中N、Fe的化合价,再写出反应方程式;
②采用极限法分析,假设生成的硝酸盐为硝酸铁或硝酸亚铁,据此确定n的范围;
③根据氧化还原反应中得失电子数相等计算确定生成物.
解答 解:(1)加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,要注意实验过程不能用玻璃棒搅拌,否则溶液出现浑浊;
当反应体系呈现红褐色,即制得氢氧化铁胶体,应立即停止加热,否则也容易出现浑浊,产生红褐色的氢氧化铁沉淀,往沸水中滴加饱和氯化铁溶液后,可稍微加热煮沸,但不宜长时间加热.长时间加热的话就会从胶体变为沉淀;
原理方程式为:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,可以用可见光束照射胶体和溶液,出现光亮的通道的是胶体,否则是溶液,
故答案为:向沸腾的水中滴加少量氯化铁饱和溶液,并继续煮沸至液体呈红褐色;丁达尔效应;
(2)电解质是在熔融状态或水溶液中能导电的化合物,包括大多数酸、碱、盐,①⑥属于电解质,电解质在熔融状态下或水溶液中能导电,金属单质和半导体材料能导电,③④能导电,故答案为:③④;①⑥;
(3)①通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,通入氯气的量为1~2mol的过程中,亚铁离子从2.5mol降到0.5mol,三价铁的量逐渐增大,此时氯气消耗完毕,所以被氧化的离子有:I-、Fe2+,故答案为:I-、Fe2+;
②如果向①的溶液中通入3mol Cl2,则被氧化的离子除了亚铁离子、碘离子之外,还有溴离子,还原产物分别是:Fe3+、I2、Br2,故答案为:Fe3+、I2、Br2;
(4)①m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m:n=1:2.7,则n(Fe):n(HNO3)=$\frac{1}{56}$:$\frac{2.7}{63}$=5:12,若生成+2价铁,则Fe失去电子为10,则硝酸得电子数为10,即生成产物为氮气,若生成+3价铁,则Fe失去电子为15,则硝酸得电子数为15,没有满足条件的产物,其反应的方程式为:5Fe+12HNO3=5Fe(NO3)2+N2↑+6H2O,
故答案为:5Fe+12HNO3=5Fe(NO3)2+N2↑+6H2O;
②铁的物质的量=$\frac{5.6g}{56g/mol}$,假设生成的是硝酸铁,根据硝酸铁的化学式知,作酸的硝酸的物质的量是铁物质的量的3倍,则作酸的硝酸的物质的量是0.3mol,有$\frac{1}{4}$的硝酸被还原,则作酸的硝酸占$\frac{3}{4}$,所以参加反应的硝酸的物质的量为0.4mol,其质量为0.4mol×63g/mol=25.2g,
假设生成的是硝酸亚铁,根据硝酸亚铁的化学式知,作酸的硝酸的物质的量是铁物质的量的2倍,则作酸的硝酸的物质的量是0.2mol,有$\frac{1}{4}$的硝酸被还原,则作酸的硝酸占$\frac{3}{4}$,所以参加反应的硝酸的物质的量为$\frac{0.8}{3}$mol,其质量为$\frac{0.8}{3}$mol×63g/mol=16.8g,
所以n的取值范围为16.8g≤n≤25.2g,
故答案为:16.8g≤n≤25.2g;
③某条件下锌和硝酸反应时的物质的量之比为2:5,则起酸作用的硝酸的物质的量是锌的2倍,剩余部分硝酸作氧化剂,氧化还原反应中得失电子数相等,所以硝酸还原产物中氮元素的平均化合价=5-$\frac{2×2}{1}$=+1,所以硝酸的还原产物为N2O或NH4NO3,
故答案为:N2O或NH4NO3.
点评 本题考查学生氧化还原反应的计算、胶体的制备和性质、电解质的概念等知识,把握发生的反应、反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,注意电子守恒的应用,题目难度中等.

| A. | 3SO2+2NO3-+2H2O═2NO↑+4H++3SO42- | |
| B. | 3SO2+Ba2++2NO3-+2H2O═BaSO4↓+2NO↑+4H++SO42- | |
| C. | 6SO2+Ba2++4NO3-+4H2O═BaSO4↓+4NO↑+8H++5SO42- | |
| D. | 3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+ |
| A. | 二氧化钛中Ti的化合价为+2 | |
| B. | 萘胺中C、H、N的原子个数比为10:9:1 | |
| C. | 二氧化钛和萘胺都是有机物 | |
| D. | 这种试纸是一种新型化合物 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向沸水中滴加少量饱和氯化铁溶液,加热至溶液呈红褐色,用激光笔照射 | 有丁达尔效应 | 红褐色液体为胶体 |
| B | 向溶液X中加入NaHCO3粉末 | 产生无色气体 | X一定属于酸 |
| C | 向淀粉NaI溶液中加入氯水 | 溶液变蓝 | 氧化性:Cl2>I2 |
| D | 将气体X分别通入溴水和酸性高锰酸钾溶液 | 两溶液均褪色 | X可能是SO2 |
| A. | A | B. | B | C. | C | D. | D |
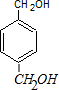 .
.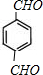 +2H2O.
+2H2O.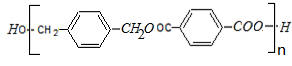 +2nNaOH$→_{△}^{NaOH溶液}$n
+2nNaOH$→_{△}^{NaOH溶液}$n +n
+n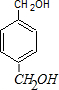 .
.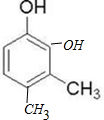 (或
(或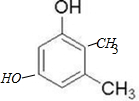 等)(只写出一种即可).
等)(只写出一种即可).

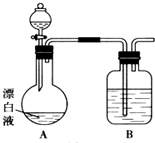 某化学兴趣小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
某化学兴趣小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.