题目内容
5.有关常温下c(H+)相同的醋酸溶液和盐酸说法中正确的是( )| A. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 | |
| B. | 分别加水稀释100倍后,两种溶液的c(H+)不再相等 | |
| C. | 中和同体积的这两种酸性溶液所需要NaOH的物质的量相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相等 |
分析 A.醋酸是弱电解质,在溶液中存在电离平衡,加醋酸根抑制电离;
B.加水稀释促进醋酸的电离;
C.醋酸中醋酸的浓度大于氢离子的浓度,盐酸的浓度等于氢离子的浓度;
D.没有告诉溶液的体积无法判断.
解答 解:A.醋酸是弱电解质,在溶液中存在电离平衡,加醋酸根抑制电离,则醋酸中加醋酸钠,溶液中氢离子的浓度减小,盐酸完全电离,加氯化钠氢离子浓度不大,故A错误;
B.氯化氢为强电解质,盐酸稀释100倍氢离子浓度变为原来的$\frac{1}{100}$;而醋酸为弱电解质,稀释后溶液中氢离子数目增多,氢离子浓度大于原来的$\frac{1}{100}$,所以分别加水稀释100倍后,两种溶液的c(H+)不再相等,故B正确;
C.醋酸中醋酸的浓度大于氢离子的浓度,盐酸的浓度等于氢离子的浓度,当c(H+)相同时,醋酸的浓度大于盐酸,所以中和同体积的这两种酸性溶液所需要NaOH的物质的量,醋酸消耗的氢氧化钠多,故C错误;
D.没有告诉醋酸与盐酸溶液的体积大小关系,所以无法判断生成氢气体积的关系,故D错误.
故选B.
点评 本题考查了弱电解质的电离平衡的应用知识,题目难度不大,注意掌握影响弱电解质电离平衡的因素.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
19.化学知识中有很多的“相等”.下列说法中不正确的是( )
| A. | 参加化学反应的各物质的总质量等于反应后生成的各物质的总质量 | |
| B. | 化合物中元素化合价的正价总数与负价总数的数值相等 | |
| C. | 溶液稀释前后溶质的质量相等 | |
| D. | 在原子中原子核内的质子数和中子数相等 |
14.下表中的实验能达到实验目的或能取出相应结论的是( )
| 选项 | 实验目的 | 实验目的或结论 |
| A | 向含有少量FeCl2的MgCl2溶液中加入足量NaOH溶液,搅拌后静置过滤 | 除去MgCl2溶液中少量FeCl2 |
| B |  | NaHCO3比Na2CO3受热更易分解 |
| C | 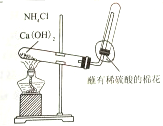 | 制取并收集氨气 |
| D | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌,过滤,沉淀用蒸馏水洗涤 | 除去Mg(OH)2样品中Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
17.浓硫酸与锌在一定条件下反应,若在反应过程中,锌与硫酸的质量比为26:49,则硫酸的还原产物为( )
| A. | SO2 | B. | S | C. | H2S | D. | ZnSO4 |
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极): 谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____ __。
谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____ __。 SCN溶液,溶
SCN溶液,溶