题目内容
17.浓硫酸与锌在一定条件下反应,若在反应过程中,锌与硫酸的质量比为26:49,则硫酸的还原产物为( )| A. | SO2 | B. | S | C. | H2S | D. | ZnSO4 |
分析 锌与硫酸的质量比为26:49,物质的量比为$\frac{26g}{65g/mol}$:$\frac{49g}{98g/mol}$=4:5,设Zn为4mol,硫酸为5mol,则生成4molZnSO4,则1mol硫酸作氧化剂,结合电子守恒计算.
解答 解:锌与硫酸的质量比为26:49,物质的量比为$\frac{26g}{65g/mol}$:$\frac{49g}{98g/mol}$=4:5,设Zn为4mol,硫酸为5mol,则生成4molZnSO4,则1mol硫酸作氧化剂,
设硫酸还原产物中S元素的化合价为x,
由电子守恒可知,4mol×(2-0)=1mol×(6-x),
解得x=-2,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,注意硫酸作酸及氧化剂,题目难度不大.

练习册系列答案
相关题目
10.下列有关描述中,不正确的是( )
| A. | 二氧化碳不但易溶于水,而且能与水发生反应 | |
| B. | 一氧化碳有毒,冬天燃煤取暖要防止煤气中毒 | |
| C. | 木炭具有吸附性,可以除去冰箱中的异味 | |
| D. | 氧气化学性质活泼,能与很多单质以及化合物发生化学反应 |
5.有关常温下c(H+)相同的醋酸溶液和盐酸说法中正确的是( )
| A. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 | |
| B. | 分别加水稀释100倍后,两种溶液的c(H+)不再相等 | |
| C. | 中和同体积的这两种酸性溶液所需要NaOH的物质的量相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相等 |
12.将0.46g金属钠投人到足量的水,充分反应中后配制成体积为0.1L的溶液,所得溶液中溶质的物质的量浓度( )
| A. | 等于0.1mol/L | B. | 等于0.2mol/L | C. | 等于0.8mol/L | D. | 等于0.4mol/L |
 医药商店销售的某种葡萄糖(化学式C6H12O6)注射液部分说明如图,测得该葡萄糖注射液中碳元素质量分数为20%.请回答下列问题:
医药商店销售的某种葡萄糖(化学式C6H12O6)注射液部分说明如图,测得该葡萄糖注射液中碳元素质量分数为20%.请回答下列问题: Si+SiC+4CO↑
Si+SiC+4CO↑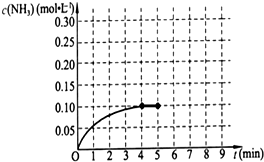 已知工业上合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,
已知工业上合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,