题目内容
10.2014年10月24日.我国探月工程三期载人返回飞行试验器在西昌卫星发射中心由长征三号丙运载火箭发射升空.某液体化合物X2Y4,常用作火箭燃料,16g X2Y4在一定量的O2中恰好完全燃烧,反应的化学方程式为X2Y4(l)+O2(g)$\frac{\underline{\;加热\;}}{\;}$X2(g)+2Y2O(l).冷却后标准状况下测得生成物的体积为11.2L,其密度为1.25g•L-1,则:(1)反应前O2的物质的量为0.5mol.
(2)X2的摩尔质量为28g/mol;Y元素的名称是氢.
(3)若反应生成0.1mol X2,则转移电子的物质的量为0.4mol.
分析 (1)由方程式可知,反应前后气体的体积不发生变化,据此计算氧气的物质的量;
(2)标准状况下,气体摩尔质量M=Vm×ρ,据此计算气体X2的摩尔质量;根据方程式计算的物质的量X2Y4,再计算X2Y4的相对分子质量,进而计算Y的相对原子质量,确定Y元素名称;
(3)根据化合价的变化计算.
解答 解:(1)由方程式可知,反应前后气体的体积不发生变化,X2和氧气的关系式为1:1,故V(O2)=V(X2)=11.2L,所以n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,故答案为:0.5mol;
(2)标准状况下,气体摩尔质量M=Vm×ρ,气体X2的摩尔质量=22.4L/mol×1.25g/L=28g/mol,11.2L X2的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,n(X2Y4)=n(X2)=0.5mol,故Mr(X2Y4)=$\frac{16}{0.5}$=32,则Y的相对原子质量=$\frac{32-28}{4}$=1,故Y为氢元素,故答案为:28g/mol;氢;
(3)反应中X化合价由-2价升高到0价,由方程式可知,生成1molX2,则转移4mol电子,若反应生成0.1mol X2,则转移电子的物质的量为0.4mol,故答案为:0.4.
点评 本题考查化学方程式的有关计算,难度不大,注意根据方程式的特征计算氧气的体积,理解气体的摩尔质量与密度的关系.

练习册系列答案
相关题目
5.有关常温下c(H+)相同的醋酸溶液和盐酸说法中正确的是( )
| A. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 | |
| B. | 分别加水稀释100倍后,两种溶液的c(H+)不再相等 | |
| C. | 中和同体积的这两种酸性溶液所需要NaOH的物质的量相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相等 |
15.下列有关物质检验的实验结论错误的是( )
| 选项 | 实验操作 | 现象 | 实验结论 |
| A | 向某溶液中加入硝酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 将某无色无味的气体通入澄清石灰水中 | 生成白色沉淀 | 该气体一定是CO2 |
| C | 往某溶液中加入AgN03溶液 | 生成白色沉淀 | 溶液中一定含有Cl- |
| D | 往某溶液中加入KSCN溶液 | 溶液呈血红色 | 溶液中一定含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
9.氨的合成是最重要的化工生产之一.
Ⅰ.合成氨用的氢气有多种制取的方法:
①活泼金属(如钠)直接跟水反应;
②金属(如锌)跟稀盐酸或稀硫酸反应;
③电解水制氢气
④由焦炭跟水反应制取氢气:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
⑤由天然气制取氢气:CH4+H2O(g)$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CO+3H2
(1)请你再补充一种制取氢气的方法,写出该反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(2)已知有关反应的能量变化如图,则方法⑤反应的焓变△H=(a+3b-c)kJ•mol-1.

Ⅱ.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如表:
(3)分析上表数据,下列关系正确的是ab(填写序号字母).
a.2c1>1.5mol/L b.2ρ1=ρ2 c.ω3=ω1
(4)在该温度下该反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}×(3{c}_{1}-1.5)^{3}}$(用含c1的代数式表示).
(5)容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol/(L.min).
Ⅲ.用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO (NH2)2(l)+H2O(g).某温度下,为进一步提高CO2的平衡转化率,下列措施中能达到目的是ab.
a.提高NH3的浓度 b.增大压强 c.及时转移生成的尿素 d.使用更高效的催化剂.
Ⅰ.合成氨用的氢气有多种制取的方法:
①活泼金属(如钠)直接跟水反应;
②金属(如锌)跟稀盐酸或稀硫酸反应;
③电解水制氢气
④由焦炭跟水反应制取氢气:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
⑤由天然气制取氢气:CH4+H2O(g)$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CO+3H2
(1)请你再补充一种制取氢气的方法,写出该反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(2)已知有关反应的能量变化如图,则方法⑤反应的焓变△H=(a+3b-c)kJ•mol-1.

Ⅱ.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | 5 | 8 | |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
a.2c1>1.5mol/L b.2ρ1=ρ2 c.ω3=ω1
(4)在该温度下该反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}×(3{c}_{1}-1.5)^{3}}$(用含c1的代数式表示).
(5)容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol/(L.min).
Ⅲ.用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO (NH2)2(l)+H2O(g).某温度下,为进一步提高CO2的平衡转化率,下列措施中能达到目的是ab.
a.提高NH3的浓度 b.增大压强 c.及时转移生成的尿素 d.使用更高效的催化剂.
 .
.
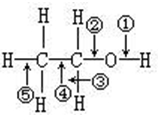 在一定条件下,一个乙醇分子断键只失去两个氢原子,生成的新有机化合物可能有(写结构简式,不一定填满)CH3CHO;
在一定条件下,一个乙醇分子断键只失去两个氢原子,生成的新有机化合物可能有(写结构简式,不一定填满)CH3CHO; ;CH2=CHOH;..
;CH2=CHOH;.. Si+SiC+4CO↑
Si+SiC+4CO↑