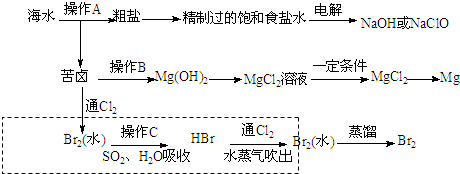
��Ŀ����
4��FeCl3���ִ���ҵ������Ӧ�ù㷺��ij��ѧ�о���ѧϰС��ģ�ҵ���������Ʊ���ˮFeCl3�����ø���ƷFeCl3��Һ�����ж���H2S��I�����������ϵ�֪����ˮFeCl3�ڿ������׳��⣬����������������������Ʊ���ˮFeCl3��ʵ�鷽����װ��ʾ��ͼ�����ȼ��г�װ����ȥ���������������£�

�ټ��װ�õ������ԣ�
��ͨ������Cl2���Ͼ�װ���еĿ�����
���þƾ�������м�·���������Ӧ���
�ܡ�
����ϵ��ȴ��ֹͣͨ��Cl2�����ø����N2�Ͼ�Cl2�����ռ����ܷ�
��ش��������⣺
��1��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ2Fe+3Cl2$\frac{\underline{\;����\;}}{\;}$2FeCl3��
��2���ڢ۲����Ⱥ����ɵ���״FeCl3�ֽ����ռ��������������ڷ�Ӧ��A�Ҷ�Ҫʹ������FeCl3�����ռ������ڢܲ��������ڳ�����FeCl3�����·����ȣ�
��3���������������У�Ϊ��ֹFeCl3��������ȡ�Ĵ�ʩ�У������ţ��ڡ��ݣ�
��4��װ��D��FeCl2ȫ����Ӧ����ʧȥ����Cl2�����ö�ʧЧ��д������FeCl2�Ƿ�ʧЧ���Լ�������KMnO4��Һ��
����ͬѧ��װ��D�еĸ���ƷFeCl3��Һ����H2S���õ��������˺�����ʯīΪ�缫����һ�������µ����Һ��
��5��FeCl3��H2S��Ӧ�����ӷ���ʽΪ2Fe3++H2S=2Fe2++S��+2H+��
��6��������H+�������ŵ����H2�������ĵ缫��ӦʽΪFe2+-e-=Fe3+��
��7���ۺϷ���ʵ����������Ӧ����֪��ʵ�������������ŵ㣺��H2S��ԭ��������Ϊ100%����FeCl3����ѭ�����ã�
���� ������̽��ģ�ҵ���������Ʊ���ˮFeCl3�����ø���ƷFeCl3��Һ�����ж���H2S���ۺ����ͣ��漰�Ʊ��Ȼ���ʱ��������ˮ������������������ԣ�Ҫ������������ķ�Ӧ�����������ü��ȵķ�ʽ���Ȼ�������������������������Fe2+�Ļ�ԭ���ø��������Һ�������������Һ�У���������Ȼ��������������������ж����壬���õ�ⷴӦ�����Һ�������ɵõ��Ȼ�����Һѭ�����ã����ԭ�ϵ������ʣ��ݴ˿�����
��1��װ��A������������Ӧ�����Ȼ�����
��2��Ҫʹ������FeCl3�����ռ���������FeCl3���������������ʣ�
��3����ֹFeCl3���⣬����ˮ�����Ӵ���
��4������FeCl2�Ƿ�ʧЧ��Ӧ����FeCl2�Ƿ���ڣ�������KMnO4��Һ���飻
��5�����������������ԣ�������л�ԭ�ԣ�����֮�䷢��������ԭ��Ӧ��
��6������Ȼ�����ʱ�����������ӵõ����ӷ�����ԭ��Ӧ������������ʧȥ���ӷ���������Ӧ��
��7������FeCl3����ѭ�����ã�
��� �⣺��1��װ��A������������Ӧ�����Ȼ�������ӦΪ2Fe+3Cl2$\frac{\underline{\;����\;}}{\;}$2FeCl3���ʴ�Ϊ��2Fe+3Cl2$\frac{\underline{\;����\;}}{\;}$2FeCl3��
��2����FeCl3���ȷ�������ʹ������FeCl3�����ռ������ʴ�Ϊ���ڳ�����FeCl3�����·����ȣ�
��3��Ϊ��ֹFeCl3��������ȡ�Ĵ�ʩ�Т�ͨ������Cl2���ø����N2�Ͼ�Cl2����ѡ���ڡ��ݣ�
��4������FeCl2�Ƿ�ʧЧ���Ǽ�������Fe2+�������Ǽ���Fe3+�Ĵ��ڣ�����ѡ��KSCN��Һ����Ӧ��ѡ��KMnO4��Һ����Fe2+�л�ԭ����ʹ���Ը��������Һ��ɫ���ʴ�Ϊ������KMnO4��Һ��
��5�����������������ԣ�������л�ԭ�ԣ�����֮�䷢��������ԭ��Ӧ��2FeCl3+H2S=2FeCl2+2HCl+S�������ӷ���ʽΪ��2Fe3++H2S=2Fe2++S��+2H+���ʴ�Ϊ��2Fe3++H2S=2Fe2++S��+2H+��
��6������Ȼ�����ʱ���������������ӵõ��ӵĻ�ԭ��Ӧ��2H++2e-�TH 2���������������ӷ���ʧ���ӵ�������Ӧ��Fe2+-e-=Fe3+���ʴ�Ϊ��Fe2+-e-=Fe3+��
��7�����������յõ���FeCl3��������������H2S���õ�ѭ�����ã��ʴ�Ϊ��FeCl3����ѭ�����ã�
���� ������һ���ۺ��⣬�Ѷ��еȣ�������ѧ������֪ʶ���������������漰����֪ʶ��϶࣬���ջ����ǹؼ���

 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д�| A�� | ����Һ�зֱ����������Ӧ�����Σ�c��H+�������Լ�С | |
| B�� | �ֱ��ˮϡ��100����������Һ��c��H+��������� | |
| C�� | �к�ͬ�����������������Һ����ҪNaOH�����ʵ������ | |
| D�� | �ֱ��������пƬ��������Һ����H2�������� |
�ϳɰ��õ������ж�����ȡ�ķ�����
�ٻ��ý��������ƣ�ֱ�Ӹ�ˮ��Ӧ��
�ڽ�������п����ϡ�����ϡ���ᷴӦ��
�۵��ˮ������
���ɽ�̿��ˮ��Ӧ��ȡ������C+H2O��g��$\frac{\underline{\;����\;}}{\;}$CO+H2��
������Ȼ����ȡ������CH4+H2O��g��$\frac{\underline{\;\;\;����\;\;\;}}{����}$CO+3H2
��1�������ٲ���һ����ȡ�����ķ�����д���÷�Ӧ�Ļ�ѧ����ʽ2Al+2NaOH+2H2O=2NaAlO2+3H2����
��2����֪�йط�Ӧ�������仯��ͼ�����ݷ�Ӧ���ʱ��H=��a+3b-c��kJ•mol-1��

����3��2L���ܱ������У�����ͬ���¶��¡�ʹ����ͬ�Ĵ����ֱ���з�Ӧ��3H2��g��+N2��g��$\frac{\underline{\;���¸�ѹ\;}}{����}$2NH3��g��������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й����������
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 3mol H2��2mol N2 | 6mol H2��4mol N2 | 2mol NH3 |
| �ﵽƽ���ʱ�䣨min�� | 5 | 8 | |
| ƽ��ʱN2��Ũ�ȣ�mol•L-1�� | c1 | 1.5 | |
| NH3��������� | ��1 | ��3 | |
| ��������ܶȣ�g•L-1�� | ��1 | ��2 |
a��2c1��1.5mol/L b��2��1=��2 c����3=��1
��4���ڸ��¶��¸÷�Ӧ��ƽ�ⳣ��K=$\frac{��2-2{c}_{1}��^{2}}{{c}_{1}����3{c}_{1}-1.5��^{3}}$���ú�c1�Ĵ���ʽ��ʾ����
��5���������з�Ӧ�ӿ�ʼ����ƽ��ķ�Ӧ����Ϊv��H2��=0.3mol/��L��min����
���ð�����ȡ����[CO��NH2��2]�ķ�ӦΪ��2NH3��g��+CO2��g��?CO ��NH2��2��l��+H2O��g����ij�¶��£�Ϊ��һ�����CO2��ƽ��ת���ʣ����д�ʩ���ܴﵽĿ����ab��
a�����NH3��Ũ�� b������ѹǿ c����ʱת�����ɵ����� d��ʹ�ø���Ч�Ĵ�����
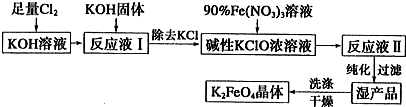
 ������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�
������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�
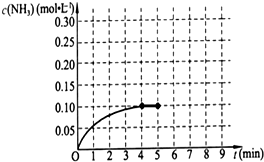 ��֪��ҵ�Ϻϳɰ��ķ�ӦΪ��N2��g��+3H2��g��?2NH3��g����H��0����һ���Ϊ2L���ܱ��ݻ��У�����0.20mol��N2��0.60mol��H2����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ��
��֪��ҵ�Ϻϳɰ��ķ�ӦΪ��N2��g��+3H2��g��?2NH3��g����H��0����һ���Ϊ2L���ܱ��ݻ��У�����0.20mol��N2��0.60mol��H2����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��ʾ�� �������������С��������淽����С�����ƽ��״̬������
�������������С��������淽����С�����ƽ��״̬������