题目内容
20.(1)写出铁与溴化合的化学方程式2Fe+3Br2=2FeBr3;(2)由上述反应,比较相关微粒的氧化性大小:Br2>Fe3+;
(3)根据(2)的结果,Br2能(能或不能)氧化Fe2+.如果能,请写出式离子方程式Br2+2Fe2+=2Fe3++2Br-,并比较相关微粒还原性大小:Fe2+>Br-;如不能,试分析原因.
(4)将氯气通入溴化亚铁溶液中,Fe2+先被氧化.
分析 (1)Fe与溴反应生成溴化铁;
(2)氧化剂的氧化性大于氧化产物的氧化性;
(3)溴与亚铁离子发生氧化还原反应生成铁离子、溴离子,结合还原剂的还原性大于还原产物的还原性分析;
(4)亚铁离子、溴离子均能被氯气氧化,还原性强的先被氧化.
解答 解:(1)Fe与溴反应生成溴化铁,反应为2Fe+3Br2=2FeBr3,故答案为:2Fe+3Br2=2FeBr3;
(2)氧化剂的氧化性大于氧化产物的氧化性,则氧化性为Br2>Fe3+,故答案为:Br2>Fe3+;
(3)溴能与亚铁离子发生氧化还原反应生成铁离子、溴离子,离子反应为Br2+2Fe2+=2Fe3++2Br-,由还原剂的还原性大于还原产物的还原性可知,还原性为Fe2+>Br-,
故答案为:能;Br2+2Fe2+=2Fe3++2Br-;Fe2+>Br-;
(4)亚铁离子、溴离子均能被氯气氧化,还原性Fe2+>Br-,则Fe2+先被氧化,故答案为:Fe2+.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握氧化性、还原性的比较方法及优先氧化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.据英国《自然》杂志报道,科学家最近研制成了以锶原子作钟摆的“光晶格钟”成为世界上最精确的钟.已知锶原子的相对原子质量为88,其质子数为38,则锶原子核内中子个数为( )
| A. | 38 | B. | 88 | C. | 50 | D. | 126 |
15.下列实验装置通常不用于物质分离提纯的是( )
| A. | 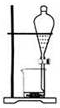 | B. | 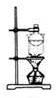 | C. | 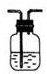 | D. | 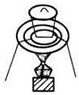 |
5.有关常温下c(H+)相同的醋酸溶液和盐酸说法中正确的是( )
| A. | 两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 | |
| B. | 分别加水稀释100倍后,两种溶液的c(H+)不再相等 | |
| C. | 中和同体积的这两种酸性溶液所需要NaOH的物质的量相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相等 |
12.将0.46g金属钠投人到足量的水,充分反应中后配制成体积为0.1L的溶液,所得溶液中溶质的物质的量浓度( )
| A. | 等于0.1mol/L | B. | 等于0.2mol/L | C. | 等于0.8mol/L | D. | 等于0.4mol/L |
 医药商店销售的某种葡萄糖(化学式C6H12O6)注射液部分说明如图,测得该葡萄糖注射液中碳元素质量分数为20%.请回答下列问题:
医药商店销售的某种葡萄糖(化学式C6H12O6)注射液部分说明如图,测得该葡萄糖注射液中碳元素质量分数为20%.请回答下列问题: 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: