题目内容
15.已知:S(l)+O2(g)=SO2(g)△H=-293.23kJ•mol-1,分析下列说法中正确的是( )| A. | S(s)+O2(g)=SO2(g),反应放出的热量大于293.23 kJ•mol-1 | |
| B. | S(g)+O2(g)=SO2(g),反应放出的热量小于293.23 kJ•mol-1 | |
| C. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 |
分析 根据物质由液态转变成固态要放出热量,由液态转变成气态要吸收热量以及放热反应中旧键断裂吸收的能量小于新键形成所放出的能量来分析.
解答 解:A、因物质由液态转变成固态要放出热量,所以S(s)+O2(g)=SO2(g)反应放出的热量小于297.23kJ•mol-1,故A错误;
B、因物质由液态转变成气态要吸收热量,所以S(g)+O2(g)=SO2(g)的反应热的数值大于297.23kJ•mol-1,故B错误;
C、因放热反应中旧键断裂吸收的能量小于新键形成所放出的能量,1molSO2的键能总和大于1molS和1molO2的键能总和,故C错误;
D、因放热反应中旧键断裂吸收的能量小于新键形成所放出的能量,1molSO2的键能总和大于1molS和1molO2的键能总和,故D正确;
故选D.
点评 本题主要考查了化学反应中反应热的计算,需要注意的是物质三态之间的转变也存在能量的变化.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
6.工业上由焦炭或夭然气制氢气的过程中会产生一氧化碳.为了除去氢气中混有的一氧化碳,可在催化剂存在的条件下将一氧化碳与水蒸气发生反应:CO(g)+H2O( g)?CO2(g)+H2(g)△H=-41.0kJ•mol-l.该反应在工业上被称为“一氧化碳变换”.
(1)写出该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$; K( 200℃)> K( 300℃)(填“>”、“=”或“<”).
(2)在773K时,一氧化碳变换反应的平衡常数K=9,如反应开始时CO和H2O的浓度都是0.020•mol-l,则在此反应条件下一氧化碳的转化率为75%.
(3)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO30%、CO210%(均为体积分数).现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,以除去其中的CO.已知不同温度及反应物投料比($\frac{n{H}_{2}O}{n(CO)}$ )下,变换后平衡混合气体中CO的体积分数如下表所示:
①从表中数据可以得到控制不同条件时CO的转化率的变化规律.能使CO的转化率升高,可改变的条件降低温度、增大反应物投料比($\frac{n{H}_{2}O}{n(CO)}$ )或原料气中水蒸气的比例.
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
③温度为300℃、$\frac{n{H}_{2}O}{n(CO)}$=1时,变换后的平衡混合气体中CO2的体积分数是24.8%.(结果保留3位有效数字).
(1)写出该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$; K( 200℃)> K( 300℃)(填“>”、“=”或“<”).
(2)在773K时,一氧化碳变换反应的平衡常数K=9,如反应开始时CO和H2O的浓度都是0.020•mol-l,则在此反应条件下一氧化碳的转化率为75%.
(3)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO30%、CO210%(均为体积分数).现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,以除去其中的CO.已知不同温度及反应物投料比($\frac{n{H}_{2}O}{n(CO)}$ )下,变换后平衡混合气体中CO的体积分数如下表所示:
| 投料比 CO体积分数/% 温度/℃ | $\frac{n{H}_{2}O}{n(CO)}$=1 | $\frac{n{H}_{2}O}{n(CO)}$=3 | $\frac{n{H}_{2}O}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
③温度为300℃、$\frac{n{H}_{2}O}{n(CO)}$=1时,变换后的平衡混合气体中CO2的体积分数是24.8%.(结果保留3位有效数字).
3.实验中的下列操作正确的是( )
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
10.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的相对原子质量呈周期性变化 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
20.下列各组物质中,不能按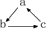 关系相互转化的是(“→”表示一步完成)( )
关系相互转化的是(“→”表示一步完成)( )
 关系相互转化的是(“→”表示一步完成)( )
关系相互转化的是(“→”表示一步完成)( )| 选项 | A | B | C | D |
| a | SiO2 | NaOH | HNO3 | Cu |
| b | Na2SiO3 | Na2CO3 | NO | CuSO4 |
| c | H2SiO3 | NaHCO3 | NO2 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
7.下列说法中肯定错误的是( )
| A. | 某原子K层上只有一个电子 | |
| B. | 某原子M层上电子数为L层电子数的4倍 | |
| C. | 某离子M层上的电子数为K层的4倍 | |
| D. | 阴离子的最外层电子数可能为2,也可能为8 |
4.用稀盐酸预处理强酸型阳离子交换树脂,使之变为HR,再用蒸馏水洗涤至中性,然后用该树脂软化100mL含0.001molMg2+的中性溶液,使Mg2+完全被树脂所交换,再用100mL蒸馏水洗涤树脂.将交换液和洗涤液收集到一起,该混合液的pH为( )
| A. | 2.0 | B. | 2.3 | C. | 3.0 | D. | 7.0 |
5.巴豆酸的结构简式为CH3CH=CHCOOH,现有①氯化氢 ②溴水 ③纯碱溶液 ④2-丙醇 ⑤酸性KMnO4溶液.在一定条件与巴豆酸反应的物质的组合是( )
| A. | 只有②④⑤ | B. | 只有①③④ | C. | ①②③④⑤ | D. | 只有①②③④ |