题目内容
【题目】下列叙述错误的是( )
A.光导纤维的主要成分是硅酸盐B.金属钠着火时不可以用水灭火
C.氧化铁常用作红色油漆和涂料D.常温下可用铝制容器盛装浓硫酸或浓硝酸
【答案】A
【解析】
A. 光导纤维的主要成分是二氧化硅,A项错误 ;
B. 过氧化钠能与水和二氧化碳发生反应生成氧气,B项正确;
C. 氧化铁俗称铁红,常用作红色油漆和涂料,C项正确
D. 常温下,铁或铝在浓硫酸中发生钝化现象使表面形成一层致密稳定的氧化膜,故铁制品或铝容器可以盛放浓硫酸,D项正确;
答案选A。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案【题目】饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.
(1)砷与磷为同一主族元素,磷的原子结构示意图为 .
(2)根据元素周期律,下列说法正确的是 .
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3 , 同时生成SO42﹣ , 导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为 .
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果: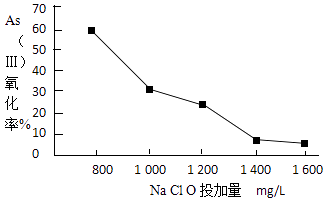
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是 .
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.
已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO3﹣ | HAsO42﹣ | HAsO42﹣、AsO43﹣ |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是 .
【题目】某学生用0.1032molL﹣1的盐酸标准溶液滴定未知浓度的KOH溶液,其操作分解为如下几步: A.取已用蒸馏水洗净的酸式滴定管,用盐酸标准溶液润洗滴定管2~3次;
B.移取20mL待测KOH注入洁净的锥形瓶中,并加入2~3滴甲基橙;
C.取标准盐酸溶液注入酸式滴定管至“0”刻度以上1~2cm;
D.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液;
E.调节液面至“0”或“0”以下某一刻度,记录读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记录滴定管液面的刻度.
完成下列问题:
(1)上述操作步骤的正确顺序是(填写字母序号).
(2)判断溶液到达滴定终点的方法是 .
(3)上述A步骤操作的目的是 .
(4)若上述B步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果产生的影响是;若称取一定量的KOH固体(含少量NaOH)配制待测溶液并用上述盐酸标准溶液进行滴定,则对滴定结果产生的影响是 , 理由是 .
(5)用0.1032molL﹣1的盐酸滴定未知浓度的KOH溶液,重复三次的实验数据如下表所示:
序号 | 消耗盐酸的体积/mL | 待测KOH溶液的体积/mL |
1 | 27.23 | 25.00 |
2 | 28.24 | 25.00 |
3 | 27.25 | 25.00 |
则待测KOH的物质的量浓度是molL﹣1 .
