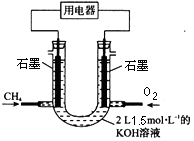
��Ŀ����
����Ŀ��ij�о���ѧϰС����ʵ������ģ��ʯ�͵Ĵ��ѻ�,װ����ͼ:ʵ������пɹ۲쵽��ƿ���й���ʯ�����ۻ�,�Թ�����������Һ������,�Թ��������Ը��������Һ��ɫ,ʵ������Թ�����Һ����ζ,�������͵���ζ��
��1����װ���������ӵ�˳��Ӧ��ѭ��ԭ��Ϊ_________________,����ҩƷ֮ǰ�IJ���Ϊ____________________________,�����ܵ�������_____________________________��
��2���Թ���������Һ������˵����_______________________��
��3���Թ�������Һ��ɫ˵����____________________________��
��4���ܷ����Թ����е�Һ����ȡ��ˮ�е���,������__________________________��
��5��д����ʮ���ѻ��õ������ϩ�Ļ�ѧ����ʽ____________________________��
��6��ʯ���ѻ�����Ҫ������_______________________________________________��
���𰸡� ��������,�������� ����װ�õ������� �������������� �ѻ�������5��̼ԭ�������ϵ��� �ѻ�������̼ԭ����С��5��ϩ�� �������ѻ���������ϩ��,�����巢���ӳɷ�Ӧ C20H42![]() C10H22+C10H20 �����ʯ�Ͳ�Ʒ������ȼ���ر������͵IJ���������
C10H22+C10H20 �����ʯ�Ͳ�Ʒ������ȼ���ر������͵IJ���������
����������1����װ���������ӵ�˳��Ӧ��ѭ�������ϡ������ҵ�ԭ����װ��ҩƷ֮ǰҪ����װ�õ�������������ʯ�ͷ���ҵ�ķ�����ԭ���������˳������������ó�������������������������������ݴ��ѻ�ԭ�������з�Ӧ���п��ܷ�����
a.C20H42![]() C10H20+C10H22��b.C10H22
C10H20+C10H22��b.C10H22![]() C5H12+C5H10��c.C5H12
C5H12+C5H10��c.C5H12![]() C2H4+C3H8��d.C5H12
C2H4+C3H8��d.C5H12![]() CH4+C4H8����2���Թܢ�����Һ������,˵��������5��̼ԭ�������ϵ�������Ϊ���³�ѹ��5��̼ԭ�������ϵ�����Һ̬����3���Թܢ���KMnO4��Һ��ɫ˵�������˳��³�ѹ�³���̬��5��̼ԭ�������µ�ϩ������4�������ѻ���������ϩ������,�����巢���ӳɷ�Ӧ�����Բ���������ȡ±�ص�������5����ʮ���ѻ��õ������ϩ�Ļ�ѧ����ʽΪC20H42
CH4+C4H8����2���Թܢ�����Һ������,˵��������5��̼ԭ�������ϵ�������Ϊ���³�ѹ��5��̼ԭ�������ϵ�����Һ̬����3���Թܢ���KMnO4��Һ��ɫ˵�������˳��³�ѹ�³���̬��5��̼ԭ�������µ�ϩ������4�������ѻ���������ϩ������,�����巢���ӳɷ�Ӧ�����Բ���������ȡ±�ص�������5����ʮ���ѻ��õ������ϩ�Ļ�ѧ����ʽΪC20H42![]() C10H20+C10H22����6�������ϱ仯���Կ�����ʯ���ѻ�����ҪĿ���ǿ����ʯ�Ͳ�Ʒ������ȼ���ر������͵IJ�����������
C10H20+C10H22����6�������ϱ仯���Կ�����ʯ���ѻ�����ҪĿ���ǿ����ʯ�Ͳ�Ʒ������ȼ���ر������͵IJ�����������

 ��ѧ�����ϵ�д�
��ѧ�����ϵ�д� �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�