题目内容
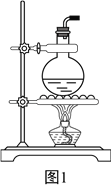
【题目】某学生用0.1032molL﹣1的盐酸标准溶液滴定未知浓度的KOH溶液,其操作分解为如下几步: A.取已用蒸馏水洗净的酸式滴定管,用盐酸标准溶液润洗滴定管2~3次;
B.移取20mL待测KOH注入洁净的锥形瓶中,并加入2~3滴甲基橙;
C.取标准盐酸溶液注入酸式滴定管至“0”刻度以上1~2cm;
D.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液;
E.调节液面至“0”或“0”以下某一刻度,记录读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记录滴定管液面的刻度.
完成下列问题:
(1)上述操作步骤的正确顺序是(填写字母序号).
(2)判断溶液到达滴定终点的方法是 .
(3)上述A步骤操作的目的是 .
(4)若上述B步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果产生的影响是;若称取一定量的KOH固体(含少量NaOH)配制待测溶液并用上述盐酸标准溶液进行滴定,则对滴定结果产生的影响是 , 理由是 .
(5)用0.1032molL﹣1的盐酸滴定未知浓度的KOH溶液,重复三次的实验数据如下表所示:
序号 | 消耗盐酸的体积/mL | 待测KOH溶液的体积/mL |
1 | 27.23 | 25.00 |
2 | 28.24 | 25.00 |
3 | 27.25 | 25.00 |
则待测KOH的物质的量浓度是molL﹣1 .
【答案】
(1)ACDEBF
(2)当溶液由黄色变为橙色,且在半分钟内不褪色
(3)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低
(4)偏高;偏高;因为同质量的NaOH比KOH中和能力强,消耗的盐酸多
(5)0.1124
【解析】解:(1)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数,再取待测液于锥形瓶,然后加入指示剂进行滴定,所以顺序为ACDEBF;所以答案是:ACDEBF;(2)用0.1032molL﹣1的盐酸标准溶液滴定未知浓度的KOH溶液,用甲基橙作指示剂,所以终点时现象是当溶液由黄色变为橙色,且在半分钟内不褪色;
所以答案是:当溶液由黄色变为橙色,且在半分钟内不褪色;(3)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2﹣3次;
所以答案是:滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低;(4)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)= ![]() 分析,测定结果偏高;同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,所以若称取KOH固体(含少量NaOH)配制标准溶液,标准溶液中氢氧根离子的浓度偏大,滴定时造成V(标)偏大,所测KOH浓度偏大;
分析,测定结果偏高;同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,所以若称取KOH固体(含少量NaOH)配制标准溶液,标准溶液中氢氧根离子的浓度偏大,滴定时造成V(标)偏大,所测KOH浓度偏大;
所以答案是:偏高;偏高;因为同质量的NaOH比KOH中和能力强,消耗的盐酸多;(5)三次滴定消耗盐酸的体积为:27.23mL,28.24mL,27.25mL,第2组数据无效,则平均消耗V(盐酸)=27.24mL,
HCl+ | KOH | ═ | KCl+ | H2O |
27.24mL×0.1032mol/L | 25.00mL×c(KOH) |
所以答案是:0.1124.
【考点精析】解答此题的关键在于理解酸碱中和滴定的相关知识,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.

【题目】在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H22NH3 . 已知加入1molN2和4molH2时,达到平衡后生成amolNH3 . 有恒温恒压下欲保持平衡时各组分的体积分数不变.填表(恒温恒压)
已知 | 起始状态物质的量/mol | 平衡时NH3的 | ||
N2 | H2 | NH3 | ||
1 | 4 | 0 | a | |
① | 1.5 | 9 | 0 | |
② | 1 | 0.5a | ||
③ | m | g(g≥4m) | 0 | |