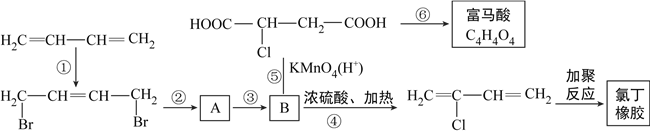
��Ŀ����
����Ŀ������ˮ�к�����ᵼ�����ж���ˮ�����ܽ������Ҫ��As�����������κ�As��������������ʽ���ڣ�
��1��������Ϊͬһ����Ԫ�أ���ԭ�ӽṹʾ��ͼΪ ��
��2������Ԫ�������ɣ�����˵����ȷ���� ��
a�����ԣ�H2SO4��H3PO4��H3AsO4
b��ԭ�Ӱ뾶��S��P��As
c���ǽ����ԣ�S��P��As
��3�����ڵ���ˮ�������Դ�ж��ּ��裬����һ����Ϊ�Ǹ�����Ļ�����FeS2��������ΪFe��OH��3 �� ͬʱ����SO42�� �� �������������������ˮ��FeS2��O2���������ӷ���ʽΪ ��
��4��ȥ��ˮ���е��飬���Ƚ�As����ת��ΪAs��������ѡ��NaClO��ʵ�ָ�ת�����о�NaClOͶ������As���������ʵ�Ӱ��õ����½����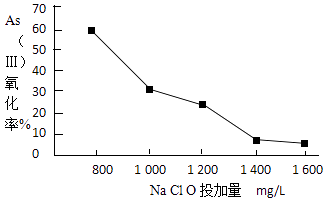
��֪��Ͷ��ǰˮ��pH=5.81��0.1mol/LNaClO��ҺpH=10.5����Һ�����������õ������Ǵ����ᣮ�����˽����ԭ���� ��
��5��ǿ�����ӽ�����������������������̬���ڵ�As�������ﵽȥ��As��Ŀ�ģ�
��֪��һ�������£�As�������Ĵ�����ʽ�����ʾ��
pH | ��2 | 2��7 | 7��11 | 11��14 |
������ʽ | H3AsO4 | H2AsO3�� | HAsO42�� | HAsO42����AsO43�� |
pH=6ʱ��NaClO���������ᣨH3AsO3�������ӷ���ʽ�� ��
���𰸡�
��1��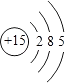
��2��ac
��3��4FeS2+15O2+14H2O=4Fe��OH��3+8SO42��+16H+
��4�����������õ������Ǵ�����,NaClO��ҺΪ����,����������ʱ,��Һ������ǿ,NaClO��ҺŨ������,ˮ��̶Ƚ���,�����������,����As���������ʽ���
��5��HClO+H3AsO3 =H2AsO4��+Cl��+2H+
���������⣺��1����ԭ�Ӻ��������Ϊ15����3�����Ӳ㣬���ﵽ����������Ϊ2��8��5����ԭ�ӽṹʾ��ͼΪ 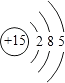 ��
��
�ʴ�Ϊ�� 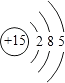 ��
��
��2��a��ͬ����������ҷǽ�������ǿ������������Ӧˮ����������ǿ��ͬ�������϶��·ǽ����Լ���������������Ӧˮ�������Լ��������ԣ�H2SO4��H3PO4��H3AsO4����a��ȷ��
b��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶��������ԭ�Ӱ뾶��As��P��S����b����
c��ͬ����������ҷǽ�������ǿ��ͬ�������϶��·ǽ����Լ������ǽ����ԣ�S��P��As����c��ȷ��
�ʴ�Ϊ��a c��
��3��FeS2ˮ��Һ�б�O2�����������ᡢ������������Ӧ�Ļ�ѧ����ʽΪ��4FeS2+15O2+14H2O=4Fe��OH��3+8SO42��+16H+��
�ʴ�Ϊ��4FeS2+15O2+14H2O=4Fe��OH��3+8SO42��+16H+��
��4��Ͷ��ǰˮ��pH=5.81��0.1mol/LNaClO��ҺpH=10.5����Һ�����������õ������Ǵ����ᣮ�����˽����ԭ���ǣ����������õ������Ǵ����ᣬNaClO��ҺΪ���ԣ�����������ʱ����Һ������ǿ��NaClO��ҺŨ������ˮ��̶Ƚ��ͣ�����������ɣ�����As���������ʽ��ͣ�
�ʴ�Ϊ�����������õ������Ǵ����ᣬNaClO��ҺΪ���ԣ�����������ʱ����Һ������ǿ��NaClO��ҺŨ������ˮ��̶Ƚ��ͣ�����������ɣ�����As���������ʽ��ͣ�
��5��pH=6ʱ��NaClO��Һ������HClO��pH=6ʱ��NaClO���������ᣨH3AsO3�������ӷ���ʽ�ǣ�HClO+H3AsO3 =H2AsO4��+Cl��+2H+��
�ʴ�Ϊ��HClO+H3AsO3 =H2AsO4��+Cl��+2H+��
��1����Ϊ15��Ԫ�أ���3�����Ӳ㣬���������Ϊ2��8��5��
��2������ͬ����Ԫ�����ʵݱ���ɽ����жϣ�
��3��FeS2ˮ��Һ�б�O2�����������ᡢ����������
��4��ͼ�������߱仯����ҺŨ��Խ����ˮ��̶�ԽС������
��5��pH=6ʱ��NaClO��Һ������HClO��ͼ�з�����֪pH=6ʱAs�������Ĵ�����ʽΪH2AsO4��.