题目内容
20.下表列出了①--⑨九种元素在周期表中的位置,请按要求回答下列问题.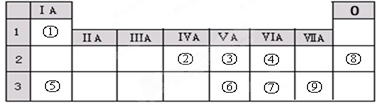
(1)元素④在周期表中所处位置第二周期ⅥA族,从元素原子得失电子的角度看,元素④具有氧化性(填“氧化性”或“还原性”);
(2)写出④⑥⑦三种元素的气态氢化物稳定性由弱到强的顺序排列:H2O>H2S>PH3(写氢化物的化学式);
(3)写出元素⑤形成的单质在氧气中燃烧的化学反应方程式2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,这一反应是放热(填“吸热”或“放热”)反应;
(4)用电子式表示①与⑨反应得到的化合物的形成过程
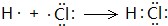 .
.(5)在①--⑨九种元素中最高价氧化物对应的水化物中,酸性最强的是(填对应化合物的化学式,下同)HClO4,碱性最强的是NaOH.
分析 由元素早周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl.
(1)元素④在周期表中位置,可知其处于第二周期ⅥA族;容易获得电子;
(2)同周期从左到右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,气态氢化物越稳定;
(3)Na在氧气燃烧生成过氧化钠;燃烧反应属于放热反应;
(4)①与⑨反应得到的化合物为HCl,属于共价化合物,用H原子、Cl原子电子式表示其形成过程;
(5)高氯酸的酸性最强;上述元素中Na的金属性最强,故氢氧化钠的碱性最强.
解答 解:由元素早周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl.
(1)元素④在周期表中位置,可知其处于第二周期ⅥA族;氧元素容易获得电子,表现氧化性,
故答案为:第二周期ⅥA族;氧化性;
(2)同周期从左到右非金属性增强、同主族自上而下非金属性减弱,故非金属性:O>S>P,非金属性越强,气态氢化物越稳定,故氢化物稳定性:H2O>H2S>PH3,故答案为:H2O>H2S>PH3;
(3)Na在氧气燃烧生成过氧化钠,反应方程式为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;燃烧反应属于放热反应,故答案为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;放热;
(4)①与⑨反应得到的化合物为HCl,属于共价化合物,用H原子、Cl原子电子式表示其形成过程为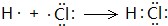 ,
,
故答案为: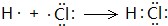 ;
;
(5)高氯酸的酸性最强,其化学式为HClO4;上述元素中Na的金属性最强,故NaOH的碱性最强,故答案为:HClO4;NaOH.
点评 本题考查元素周期表和元素周期律的综合应用,熟练掌握元素周期律知识,注意用电子式表示物质或化学键的形成,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 含有非极性共价键的化合物分子一定是非极性分子 | |
| B. | 原子晶体中只存在非极性共价键 | |
| C. | 冰主要是水分子通过氢键作用而形成的分子晶体 | |
| D. | 若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q |

| A. | 用25 mL酸式滴定管量取20.00 mL KMnO4溶液 | |
| B. | 图1可表示0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| C. | 做导电实验时,强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | 其它条件相同下,图2可探究Fe3+和Cu2+对H2O2分解反应的催化效果 |
| A. | CO2的水溶液导电能力很弱,所以CO2是弱电解质 | |
| B. | 强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 | |
| C. | 在水溶液中能离解为自由移动的离子的化合物是电解质 | |
| D. | 在强电解质的水溶液中只有离子没有分子 |
| A. | 3,3-二甲基-2-戊烯 | B. | 2-甲基-4-乙基-1-己烯 | ||
| C. | 3-甲基-2-戊烯 | D. | 2,2-二甲基丁烷 |
| A. | 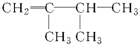 | B. | 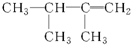 | C. |  | D. | 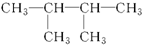 |
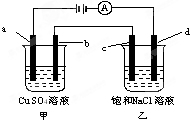
| A. | 甲烧杯中溶液的pH增大,乙烧杯中溶液的pH减小 | |
| B. | 甲烧杯中a电极发生氧化反应,电极反应式为:4OH--4e-═O2↑+2H2O | |
| C. | 电解一段时间后,b极质量增加,c极附近滴加酚酞溶液变红 | |
| D. | C是阳极,电子从d电极通过溶液流向c电极 |
| A. | 如果烃中各元素的质量百分含量都相同,则它们必定是同系物 | |
| B. | 相对分子质量相同但结构不同的物质一定是同分异构体 | |
| C. | 从物质的红外光谱图可以获得分子中含有化学键或官能团的信息 | |
| D. | 从核磁共振氢谱图可以推知该有机物分子有几种不同类型的氢原子及他们的数目 |
 先进的高能量密度二次电池对下一代电动汽车的发展和可再生能源发电的有效利用具有至关重要的作用.室温Al-Mn2O4二次电池是一种新型电池,由Al3+、Al2Cl7和${AlCl}_{4}^{-}$组成的离子液体为该电池的电解液,电池结构如图所示,放电时的总反应式为Al+Mn2O4═AlMn2O4.下列说法正确的是( )
先进的高能量密度二次电池对下一代电动汽车的发展和可再生能源发电的有效利用具有至关重要的作用.室温Al-Mn2O4二次电池是一种新型电池,由Al3+、Al2Cl7和${AlCl}_{4}^{-}$组成的离子液体为该电池的电解液,电池结构如图所示,放电时的总反应式为Al+Mn2O4═AlMn2O4.下列说法正确的是( )| A. | 放电时,负极的电池反应式为AlMn2O4-3e-═Mn2O4+Al3+ | |
| B. | 放电时,Al3+向负极移动 | |
| C. | 充电时,Mn2O4极与电源的负极相连 | |
| D. | 充电时,Al电极质量增加 |