题目内容
12.如图,a、b、c、d均为石墨电极,下列说法正确的是( )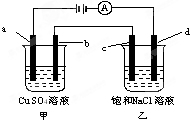
| A. | 甲烧杯中溶液的pH增大,乙烧杯中溶液的pH减小 | |
| B. | 甲烧杯中a电极发生氧化反应,电极反应式为:4OH--4e-═O2↑+2H2O | |
| C. | 电解一段时间后,b极质量增加,c极附近滴加酚酞溶液变红 | |
| D. | C是阳极,电子从d电极通过溶液流向c电极 |
分析 由图可知,甲中a与电源正极相连,则a为阳极,b为阴极;乙中c为阳极,d为阴极;电极是惰性电极,溶液中的离子放电,依据离子放电顺序写出电极反应分别为甲池中阳极a电极反应:4OH--4e_=2H2O+O2↑;阴极b电极反应为:2Cu2++4e-=2Cu;乙池中的阳极c电极反应为:4Cl--4e-=2Cl2↑;阴极d电极反应为:4H++4e-=2H2↑;甲中发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,以此来解答.
解答 解:甲中a与电源正极相连,则a为阳极,b为阴极;乙中c为阳极,d为阴极;电极是惰性电极,溶液中的离子放电,依据离子放电顺序写出电极反应分别为甲池中阳极a电极反应:4OH--4e_=2H2O+O2↑;阴极b电极反应为:2Cu2++4e-=2Cu;乙池中的阳极c电极反应为:4Cl--4e-=2Cl2↑;阴极d电极反应为:4H++4e-=2H2↑;甲中发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
A、甲中发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,乙中发生2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,甲烧杯中溶液的pH减小,乙烧杯中溶液的pH增大,故A错误;
B、a与电源正极相连,则a为阳极,电极反应:4OH--4e_=2H2O+O2↑,故B正确;
C、b为阴极;电极反应为:Cu2++2e-=Cu,电极质量增加,乙池中的阳极c电极反应为:4Cl--4e-=2Cl2↑,c极附近滴加酚酞溶液不会变红,故C错误;
D、乙中c为阳极,电子从阳极流向阴极,但是电子只能走导线,不会经过电解质溶液,故D错误.
故选B.
点评 本题考查了原电池和电解池的工作原理应用,电极判断,电极反应书写,电子转移的计算应用,明确两个烧杯中的电极反应是解答本题的关键,并注意装置特点及电子守恒来解答,题目难度不大

 名校课堂系列答案
名校课堂系列答案| A. | 氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 | |
| B. | 过氧化氢中加入几滴氯化铁溶液,可较快放出气体 | |
| C. | 在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 | |
| D. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
①1molX与足量金属钠反应产生1.5mol气体;
②在有浓H2SO4和加热条件下,X与醇或羧酸均反应生成有香味的产物;
③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应.
根据上述信息,对X的结构判断正确的是( )
| A. | X中含有碳碳双键 | B. | X中含有一个羧基和两个羟基 | ||
| C. | X中含有两个羧基和一个羟基 | D. | X中含有三个羟基和一个-COOR |
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀盐酸 | Na2S | 漂粉精溶液 | 酸性:盐酸>氢硫酸>次氯酸 | |
| B | 浓盐酸 | KMnO4 | Na2S溶液 | 氧化性:KMnO4>Cl2>S | |
| C | 浓氨水 | NaOH | 酚酞 | 碱性:NaOH>NH3•H2O | |
| D | 浓硫酸 | Na2SO3 | BaCl2溶液 | SO2与可溶性钡盐均不反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2分子中只含σ键,不含π键 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
| A. | 氢 | B. | 钙 | C. | 铁 | D. | 碘 |
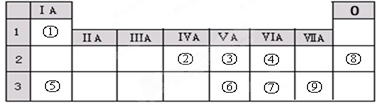
 .
.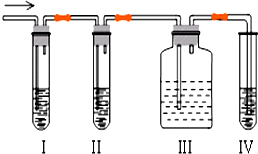 石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:
石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题: