题目内容
10. 先进的高能量密度二次电池对下一代电动汽车的发展和可再生能源发电的有效利用具有至关重要的作用.室温Al-Mn2O4二次电池是一种新型电池,由Al3+、Al2Cl7和${AlCl}_{4}^{-}$组成的离子液体为该电池的电解液,电池结构如图所示,放电时的总反应式为Al+Mn2O4═AlMn2O4.下列说法正确的是( )
先进的高能量密度二次电池对下一代电动汽车的发展和可再生能源发电的有效利用具有至关重要的作用.室温Al-Mn2O4二次电池是一种新型电池,由Al3+、Al2Cl7和${AlCl}_{4}^{-}$组成的离子液体为该电池的电解液,电池结构如图所示,放电时的总反应式为Al+Mn2O4═AlMn2O4.下列说法正确的是( )| A. | 放电时,负极的电池反应式为AlMn2O4-3e-═Mn2O4+Al3+ | |
| B. | 放电时,Al3+向负极移动 | |
| C. | 充电时,Mn2O4极与电源的负极相连 | |
| D. | 充电时,Al电极质量增加 |
分析 A、放电是原电池的工作原理,负极上发生失电子的氧化反应;
B、放电是原电池的工作原理,阳离子移向正极;
C、充电时,原电池的负极和与电源的负极相连;
D、充电时,在电解池的阴极上发生得电子的还原反应.
解答 解:A、据电池反应Al+Mn2O4═AlMn2O4分析,Al失电子发生氧化反应,负极上反应式为Al-3e-═Al3+,故A错误;
B、放电是原电池的工作原理,阳离子移向正极,即Al3+向正极移动,故B错误;
C、充电时,原电池的负极和与电源的负极相连,放电时,Mn2O4极是原电池的正极,应该与电源的正极相连,故C错误;
D、充电时,Al电极和电源负极相连做阴极,在电解池的阳极上发生失电子的氧化反应,Mn2O4+Al3++3e-═AlMn2O4,电极质量增加,故D正确.
故选D.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
1.前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体.已知H2O2的结构式为H-O-O-H,下列说法中不正确的是( )
| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2分子中只含σ键,不含π键 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
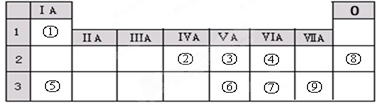
18.表是元素周期表的一部分,有关说法正确的是( )
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A. | e的氢化物比d的氢化物稳定 | |
| B. | a、b、e三种元素的原子半径:e>b>a | |
| C. | 六种元素中,c元素单质的化学性质最活泼 | |
| D. | c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
5.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
| A. | 原子半径:X>Y>Z | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 原子序数:X>Y>Z |
15.下列实验操作可以达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 验证乙炔能被酸性高锰酸 钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性 高锰酸钾溶液,观察溶液是否褪色 |
| B | 验证苯和液溴在FeBr3的 催化下发生取代反应 | 将反应产生的混合气体通入AgNO3溶液上方, 观察是否有淡黄色沉淀生成 |
| C | 除去乙酸乙酯中混有的少 量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液, 取出上层液体 |
| D | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝 酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
2.在下列元素中,不属于主族元素的是( )
| A. | 氢 | B. | 钙 | C. | 铁 | D. | 碘 |
19.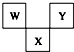 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 | |
| C. | X元素的氧化物、氢化物的水溶液都呈酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
19.下列物质中,一定与CH2=CH(CH2)3CH3互为同系物的是( )
| A. | C2H4 | B. | C4H8 | C. | (CH3)2C=CHCH2CH3 | D. | CH2=CHCH2CH=CH2 |
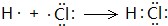 .
.