题目内容
16.(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5-8.6之间.某地海水中主要离子的含量如表:| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
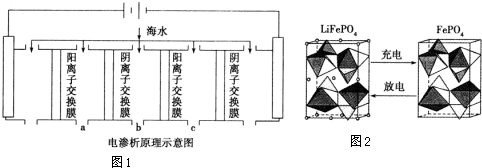
电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
①阴极的电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑.
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式Ca2++OH-+HCO3-=CaCO3↓+H2O.
③淡水的出口为a、b、c中的b出口.
(2)锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图2所示:
该电池电解质为传导Li+的固体材料.放电时该电极是电池的正极(填“正”或“负”),电极反应式为FePO4+e-+Li+=LiFePO4.
(3)目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理.
①用K2FeO4处理中性废水时,K2FeO4与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的聚沉 作用.
②MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:MFe2Ox$→_{SO_{2}}^{常温下}$MFe2Oy 则可以判断x<y,氧化性:MFe2Oy< SO2(填“>”、“<”或“=”)
分析 (1)①由电渗析法淡化海水示意图可知,阴(阳)离子交换膜仅允许阴(阳)离子通过;阴极上是阳离子得到电子发生还原反应;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(2)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应;
(3)①用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式;氢氧化铁胶体具有吸附作用;
②根据化合价的变化判断反应物在反应中是氧化剂还是还原剂或是催化剂,根据化合价代数和为0判断x与y的关系.
解答 解:(1)①阴极上是阳离子得到电子发生还原反应,氢离子放电能力大于钠离子,所以电极反应为:2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑,
故答案为:2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙,生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Ca2++OH-+HCO3-=CaCO3↓+H2O;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过用一段时间海水中的 阴阳离子在两个电极放电,所以水在b处流出,
故答案为:b;
(2)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e-+Li+=LiFePO4,
故答案为:正;FePO4+e-+Li+=LiFePO4;
(3)①用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,铁元素化合价降低,氧元素化合价升高生成氧气,结合电荷守恒配平书写离子方程式为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑;氢氧化铁胶体具有吸附作用,能吸附悬浮在水中的杂质净水,发生聚沉;
故答案为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑;聚沉;
②在图示反应中,SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,氧化剂氧化性大于氧化产物,二氧化硫氧化性大于MFe2Oy;SO2在反应中为氧化剂,参与氧化还原反应,MFe2Ox为还原剂,反应后Fe元素的化合价升高,根据化合价代数和,则有(2y-2)>(2x-2),即y>x,
故答案为:<;<.
点评 本题考查了化学电源新型电池,电解池原理分析判断,海水淡化的电渗析原理的分析判断,题目难度中等,掌握原理即可解答,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | B. | c(Na+)=2c(HS-)+2c(S2-)+c(H2S) | ||
| C. | c(Na+)>c(OH-)>c(HS-)>c(H+) | D. | c(H2S)+c(HS-)+c(H+)=c(OH-) |
| A. | 15种 | B. | 6种 | C. | 4种 | D. | 2种 |
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| B. | 向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
| A. | 0.10mol•L-1 | B. | 0.15mol•L-1 | C. | 0.225mol•L-1 | D. | 0.30mol•L-1 |
| A. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1 LpH=13的NaOH溶液中,由水电离出的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 2L0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA |
| A. | l mol氯气在足量铁中反应,转移的电子数为3NA | |
| B. | 标准状况下22.4 LH2中含中子数为2 NA | |
| C. | 1 L Imol/L的氯化钠溶液中,所含氯化钠分子数为NA | |
| D. | 常温下46gNO2和N2O4混合气体中含有原子数为3NA |
| A. | CO2 | B. | CaCl2 | C. | NH4Cl | D. | NaOH |