题目内容
【题目】已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=xkJ·mol–1,不同条件下反应过程能量变化如图所示。下列说法中不正确的是( )
2SO3(g) ΔH=xkJ·mol–1,不同条件下反应过程能量变化如图所示。下列说法中不正确的是( )

A.反应的ΔH<0
B.过程b使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.过程b发生两步反应,第一步为吸热反应
【答案】C
【解析】
A. 由图中信息可知,该反应的反应物的总能量高于生成物的总能量,故该反应为放热反应,反应的ΔH<0,A说法正确;
B.只有使用催化剂才可以降低反应的活化能。由图中信息可知,过程b的活化能比过程a的低,因此可以判断过程b使用了催化剂,B说法正确;
C. 催化剂可以同等程度地加快正反应速率和逆反应速率,因此,使用催化剂不能提高SO2的平衡转化率,C说法不正确;
D. 由图中信息可知,过程b发生两步反应,第一步生成中间产物,中间产物的总能量高于反应,因此第一步为吸热反应,D说法正确。
综上所述,相关说法中不正确的是C,故选C。

【题目】甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇时,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1= -99kJmol-1
CH3OH(g) △H1= -99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2= 58kJmol-1
CH3OH(g)+H2O(g) △H2= 58kJmol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41kJmol-1
CO(g)+H2O(g) △H3=+41kJmol-1
(1)一定温度下,向体积为2L的密闭容器中加入CO和H2,假设只发生反应①,达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①列式并计算平衡常数K=___。
②若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是___。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__v逆(填“>”、“<”或“=”)。
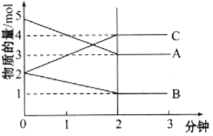
(2)在实际生产中,当合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示。
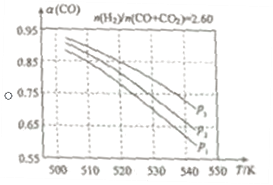
α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图中的压强由大到小为___,其判断理由是___。