题目内容
【题目】有机物1是一种常见的植物两味油,常用脂肪烃A和芳香烃D按如下路线合成:

已知:①R1CHO+R2CH2CHO![]()

![]()

②通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的名称是___,H含有的官能团名称是_____。
(2)②的反应条件是___。⑦的反应类型是______。
(3)I的结构简式是________。
(4)④的化学方程式是_________。
(5)L是I的同分异构体且含有相同官能团,其结构中苯环上只有两个处于对位的取代基,则L共有_种(不考虑立体异构)
(6)参照以上合成路线,设计以C为原料制备保水树脂 的合成路线(无机试剂任选)__ 。
的合成路线(无机试剂任选)__ 。
【答案】乙烯 羧基、碳碳双键 铜、氧气、加热 酯化反应 ![]()
![]() +2NaOH
+2NaOH![]()
![]() +2NaCl+H2O 10 CH3CHO
+2NaCl+H2O 10 CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH=CHCOOH
CH3CH=CHCOOH![]()
【解析】
由D的分子式,可确定其结构简式为![]() ,与Cl2在光照条件下发生取代反应,生成E的结构简式为
,与Cl2在光照条件下发生取代反应,生成E的结构简式为![]() ,在NaOH水溶液中发生水解反应生成F,其结构简式为,
,在NaOH水溶液中发生水解反应生成F,其结构简式为,![]() ;由I的分子式,可确定A分子中含有2个碳原子,由反应⑤的条件,与信息①进行比较,可确定C为CH3CHO,则B为CH3CH2OH,A为CH2=CH2。反应生成G的结构简式为
;由I的分子式,可确定A分子中含有2个碳原子,由反应⑤的条件,与信息①进行比较,可确定C为CH3CHO,则B为CH3CH2OH,A为CH2=CH2。反应生成G的结构简式为![]() ,H为
,H为![]() ,I为
,I为![]() 。
。
(1)由以上分析知,A的结构简式为CH2=CH2,名称是乙烯,H为![]() ,含有的官能团名称是羧基、碳碳双键。答案为:乙烯;羧基、碳碳双键;
,含有的官能团名称是羧基、碳碳双键。答案为:乙烯;羧基、碳碳双键;
(2)反应②为CH3CH2OH氧化为CH3CHO,则反应条件是铜、氧气、加热。反应⑦为![]() 转化为
转化为![]() ,反应类型是酯化反应。答案为:铜、氧气、加热;酯化反应;
,反应类型是酯化反应。答案为:铜、氧气、加热;酯化反应;
(3)由以上分析知,I的结构简式是![]() 。答案为:
。答案为:![]() ;
;
(4)反应④为![]() 生成
生成![]() ,化学方程式是
,化学方程式是![]() +2NaOH
+2NaOH![]()
![]() +2NaCl+H2O。答案为:
+2NaCl+H2O。答案为:![]() +2NaOH
+2NaOH![]()
![]() +2NaCl+H2O;
+2NaCl+H2O;
(5)L是I的同分异构体且含有相同官能团,其结构中苯环上只有两个处于对位的取代基,若1个取代基为-CH=CH2,则另一取代基为-COOCH3、-OOCCH3、-CH2OOCH;若1个取代基为-CH3,则另一取代基为-CH=CHOOCH、-OOC-CH=CH2、-COOCH=CH2、![]() ;若1个取代基为-OOCH,则另一取代基为-CH2CH=CH2、-CH=CHCH3、
;若1个取代基为-OOCH,则另一取代基为-CH2CH=CH2、-CH=CHCH3、![]() ,则L共有10种(不包括立体异构)。答案为:10;
,则L共有10种(不包括立体异构)。答案为:10;
(6) C为CH3CHO,由高聚物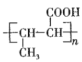 确定单体为CH3CH=CHCOOH,则依据信息①,两个CH3CHO先在NaOH水溶液中反应,再加热,从而生成CH3CH=CHCHO,再用银氨溶液氧化即得CH3CH=CHCOOH,然后发生加聚反应从而生成
确定单体为CH3CH=CHCOOH,则依据信息①,两个CH3CHO先在NaOH水溶液中反应,再加热,从而生成CH3CH=CHCHO,再用银氨溶液氧化即得CH3CH=CHCOOH,然后发生加聚反应从而生成 。合成路线为CH3CHO
。合成路线为CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH=CHCOOH
CH3CH=CHCOOH![]()
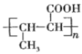 。答案为:CH3CHO
。答案为:CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH=CHCOOH
CH3CH=CHCOOH![]()
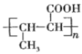 。
。

【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出重要贡献的科学家。利用废旧二次电池[主要成分为Ni(OH)2、Fe2O3、MnO2、碳粉、铝箔等]合成电池级Ni(OH)2的工艺流程如下:
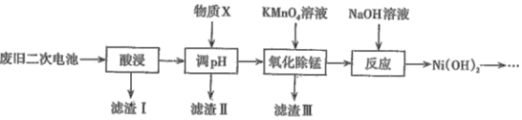
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Mn(OH)2 |
Ksp(室温下) | 4.0×10-38 | 1.0×10-33 | 1.6×10-14 | 2.0×10-13 |
(1)①已知“酸浸”后滤液中含有:Ni2+、Al3+、Fe3+、Mn2+,调节溶液的pH约为5,其目的是__;以下最适合作为物质X的是____(填字母)。
A.双氧水 B.氨水 C.盐酸 D.NiO
②若滤液中Ni2+的浓度为2molL-1,列式计算判断此时滤渣Ⅱ中是否有Ni(OH)2沉淀:___ 。
(2)滤渣Ⅲ的主要成分是____,“氧化除锰”过程发生反应的离子方程式为______。
(3)用Ni(OH)2和LiOH在空气中混合加热至700℃~800℃可制得LiNiO2(镍酸锂),该反应的化学方程式为___________。
(4)镍酸锂是一种有较好前景的锂离子电池正极材料。该电池在充放电过程中,发生LiNiO2和Li1-xNiO2之间的转化,充电时LiNiO2在_______(填“阴”或“阳“)极发生反应,该电极的电极反应式为_____。