题目内容
【题目】甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇时,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1= -99kJmol-1
CH3OH(g) △H1= -99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2= 58kJmol-1
CH3OH(g)+H2O(g) △H2= 58kJmol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41kJmol-1
CO(g)+H2O(g) △H3=+41kJmol-1
(1)一定温度下,向体积为2L的密闭容器中加入CO和H2,假设只发生反应①,达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①列式并计算平衡常数K=___。
②若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是___。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__v逆(填“>”、“<”或“=”)。
(2)在实际生产中,当合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示。
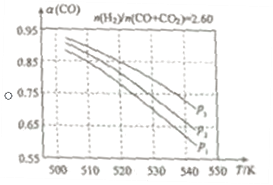
α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图中的压强由大到小为___,其判断理由是___。
【答案】![]() L2moL-2(或0.67L2 moL-2) 1molL-1<c(H2)<2molL-1 = 减小 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;从而得出:随温度升高,使CO的转化率降低 p3>p2>p1 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高
L2moL-2(或0.67L2 moL-2) 1molL-1<c(H2)<2molL-1 = 减小 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;从而得出:随温度升高,使CO的转化率降低 p3>p2>p1 相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高
【解析】
(1)①平衡常数K=![]() ,代入表中数据即可求出K。
,代入表中数据即可求出K。
②若将容器体积压缩为1L,预测c(H2)的取值范围,若平衡不移动,c(H2)=2.0mol/L,当平衡移动达新平衡后,c(H2)>1.0mol/L(平衡移动只能减弱这种改变,所以比原平衡时的浓度大),最终c(H2)介于两个极端点之间。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,利用浓度商与K进行比较,确定平衡移动的方向,从而确定v正与v逆的相对大小。
(2)从图中可以看出,α(CO)值随温度升高而减小,其原因可从①CO(g)+2H2(g)![]() CH3OH(g) △H1= -99kJmol-1 ③CO2(g)+H2(g)
CH3OH(g) △H1= -99kJmol-1 ③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41kJmol-1两个反应进行分析。图中压强的大小关系仍可从①、③两个反应进行分析。
CO(g)+H2O(g) △H3=+41kJmol-1两个反应进行分析。图中压强的大小关系仍可从①、③两个反应进行分析。
(1)①平衡常数K=![]() =
=![]() L2moL-2(或0.67L2 moL-2);答案为:
L2moL-2(或0.67L2 moL-2);答案为:![]() L2moL-2(或0.67L2 moL-2);
L2moL-2(或0.67L2 moL-2);
②若将容器体积压缩为1L,可预测c(H2)的取值范围。若平衡不移动,c(H2)=2.0mol/L,当平衡移动达新平衡后,c(H2)>1.0mol/L(平衡移动只能减弱这种改变,所以比原平衡时的浓度大),最终c(H2)介于两个极端点之间,即1molL-1<c(H2)<2molL-1;答案为:1molL-1<c(H2)<2molL-1;
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,浓度商Q=![]() =K,所以平衡不发生移动,从而确定v正=v逆。答案为:=。
=K,所以平衡不发生移动,从而确定v正=v逆。答案为:=。
(2)从图中可以看出,α(CO)值随温度升高而减小,其原因为:升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;从而得出:随温度升高,使CO的转化率降低。
对于反应①,压强大则CO的转化率大,对于反应③,压强改变平衡不发生移动,CO的转化率不变,所以,CO转化率大,则表明压强大,由此可得p3>p2>p1;其判断理由是:
相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高。答案为:减小;升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又使产生CO的量增大;从而得出:随温度升高,使CO的转化率降低;p3>p2>p1;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响。故增大压强时,有利于CO的转化率升高。

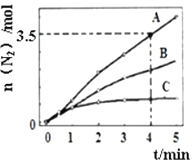
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度/℃ | T1 | T2 | T2 |
反应物起始量 | 0.5molA 1.5 molB | 0.5 molA 1.5 molB | 2.0 molA 6.0 molB |

下列说法正确的是
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.l0min内甲容器中反应的平均速率v(B)=0.025mol·(L·min)-1
D.T1℃,若起始时甲容器中充入1.5molA、0.5molB,平衡时B的转化率为25%