题目内容
【题目】乙烯是重要化工原料,其产量是一个国家石油化工水平的标志。请回答:
(一)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
【工艺甲】![]()
【工艺乙】![]()
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应。因此,上述生产工艺中,应采用工艺__________(填“甲”或“乙”)更环保、更经济。
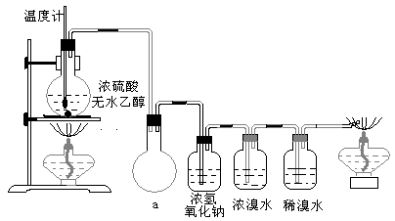
(二)某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应)。请回答下列问题:
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷烃发生反应:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为________,乙的结构简式为____________________________________。
4乙,则甲的分子式为________,乙的结构简式为____________________________________。
(2)B装置中的实验现象可能是________,写出反应的化学方程式:________________________,其反应类型是________。
(3)C装置中可观察到的现象是____________,反应类型是________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填字母)中的实验现象可判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,简述其理由: __________________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________(选填字母,下同);除去甲烷中乙烯的方法是________。
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,甲烷火焰明亮而乙烯产生少量黑烟,原因是___________________。
【答案】(一)乙 (1分) (二)(1)C8H16(1分) CH2=CH2(1分) (2)橙色(或橙黄色)褪去(1分)
CH2=CH2+Br2→BrCH2—CH2Br(2分) 加成反应(1分)(3)紫色(或紫红色)褪去(1分)
氧化反应(1分) (4)D(1分)若乙烯与溴发生取代反应生成HBr,其溶液酸性会显著增强(1分)
(5)BC(2分) B(1分) (6)乙烯中碳的质量分数为85.7%,大于甲烷中碳的质量分数(75%)(2分)
【解析】
试题分析:(一)由反应产物可知,工艺乙原子利用率为100%,在实际生产中,应采用工艺乙更环保、更经济。
(二)(1)根据原子守恒可知甲的分子式为C8H16,乙的分子式为C2H4,结构简式为CH2=CH2;
(2)乙烯和溴水发生加成反应,实验现象为橙色(或橙黄色)褪去,反应的方程式为CH2=CH2+Br2→BrCH2CH2Br;
(3)乙烯能够被酸性高锰酸钾溶液氧化,因此现象是紫红色褪去;
(4)CO2能使澄清石灰水变浑浊,如果D装置变浑浊,说明该资料的事实;若乙烯与溴发生取代反应生成HBr,其溶液酸性会显著增强,可以测定装置B中溶液在反应前后的酸碱性,探究溴与乙烯反应是加成反应而不是取代反应;
(5)检验甲烷和乙烯,利用乙烯能使溴水褪色或酸性高锰酸钾溶液褪色,而甲烷不行,因此选项BC正确;除去甲烷中的乙烯,不能引入新杂质,不能用酸性高锰酸钾溶液,因为产生CO2,因此采用溴水,选项B正确;
(6)乙烯中碳的质量分数为85.7%,大于甲烷中碳的质量分数(75%),所以甲烷火焰明亮而乙烯产生少量黑烟。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】 I.在实验室利用下列装置,可制备某些气体并验证其化学性质。
完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | __________________ | _________________________ |
(2) | 乙炔 | A→C→E | _________________________ |
II.工业上用乙烯、氯化氢和氯气为原料,经下列各步合成聚氯乙烯(PVC):

A的结构简式是__________________________________________________;
反应④的化学方程式是_________________________________________。