��Ŀ����
����Ŀ��1����������������Ӧ��
A��NaOH + HCl = NaCl + H2O
B��2FeCl3 + Cu = 2FeCl2 + CuCl2
����������Ӧ�����ж�, ����Ƴ�ԭ���(����A������B��)��
�����(A��B)������˵����ԭ�� ��
2���о������к������Ҫ��SO2��H2S����ת��������Ҫ���塣
��1����ʪ�����£�д��������SO2ת��ΪHSO3-�ķ���ʽ��_____________��
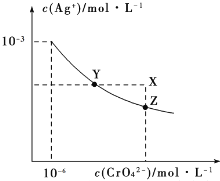
��2�������е�����ɽ�������H2S��������Ӧ������SO42-��������Ӧ�������仯ʾ��ͼ���£�
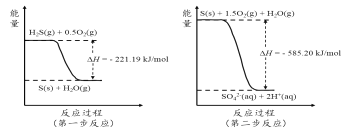
1mol H2S��g��ȫ��������SO42-��aq�����Ȼ�ѧ����ʽΪ______________________��
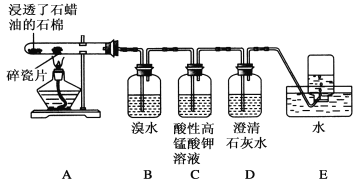
��3�������������������ӽ���Ĥȼ�ϵ�ؿ������ô�������SO2������������װ��ʾ��ͼ���£�

���ӵ���������Ϊ___________������A��B��������B��A������
���𰸡���B �� A��ӦΪ��������ԭ��Ӧ��û�е���ת��
��1��SO2+H2O ![]() H2SO3��H2SO3
H2SO3��H2SO3 ![]() H++HSO3-
H++HSO3-
��2��H2S��g��+ 2O2��g��=SO42-��aq��+ H+��aq�� ��H=��806��39 kJ��mol��1 ��3����A��B
��������
���������1�������кͷ�Ӧ��Ϊ��������ԭ��Ӧ��û�е���ת�����������Ϊԭ��أ������Է����е�������ԭ��Ӧ���������Ϊԭ��ء�
2����1����ʪ��������������SO2ת��ΪHSO3-�ķ���ʽΪSO2+H2O![]() H2SO3��H2SO3
H2SO3��H2SO3 ![]() H++HSO3-��
H++HSO3-��
��2������ͼ��������H2S(g)+![]() O2(g)=S(s)+H2O(g)��H =-221.19kJ/mol����S(s)+
O2(g)=S(s)+H2O(g)��H =-221.19kJ/mol����S(s)+![]() O2(g)= SO42-(aq) +2H+(aq)��H =-585.20kJ/mol�����ݸ�˹���ɿ�֪����+������������Ӧ��H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ��H=-221.19kJ/mol+��-585.20kJ/mol��=��806.39 kJ/mol��
O2(g)= SO42-(aq) +2H+(aq)��H =-585.20kJ/mol�����ݸ�˹���ɿ�֪����+������������Ӧ��H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ��H=-221.19kJ/mol+��-585.20kJ/mol��=��806.39 kJ/mol��
��3���ٸ���ͼʾ��AΪȼ�ϵ�صĸ�����BΪȼ�ϵ�ص���������ԭ��ص��Һ�У�������ɸ����������ƶ�������A��B��

����Ŀ��
���� | ʵ����� | ʵ����Ʒ |
I | ���ɺ������ջһ� |
|
II | ���������ܽ⡢���� |
|
III | ������Һ�е�I������Ӧ�����ӷ���ʽΪ �� |
|
IV | ȡ����III�з�Ӧ����Һ���Թ��У���������CCl4�����ã��۲쵽 �� ��˵�������к��е�Ԫ�� |
|
��2���������ư�ˮ��1mol/L NaBr��Һ������Һ���Լ�II��������Һ����֤±�ص��������Ե����ǿ����
V�ֱ�ȡ5mL 1mol/L NaBr��Һ����֧С�Թ���
VI����֧�Թ��зֱ�μ�5��������ˮ����Һ����Ϊ��ɫ
VII������һ֧�Թ��м����μ�������ˮ��ֱ����Һ��Ϊ�غ�ɫ
VIII����
����д������VI�з�Ӧ�����ӷ���ʽ ��Ϊ��֤���������ǿ�ڵ⣬����VIII�IJ����������ǣ� ����Һ��Ϊ��ɫ���ټ��� ����Һ��Ϊ��ɫ��
������VII��Ŀ���� ��
���ȡ��塢�ⵥ�ʵ�������������ԭ��ͬ����Ԫ�ش��ϵ��£� ���õ��������������ǽ����Լ�����