题目内容
【题目】运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g) ![]() SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
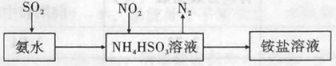
NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
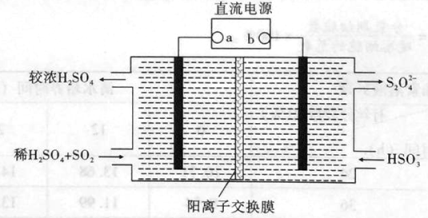
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
【答案】(1)574.1;
(2)①![]() ②
②![]() ③0.2n mol
③0.2n mol
(3)2NO2+4HSO3=N2+4SO42-+4H+
(4)①2HSO3-+2H++2e= S2O42-+2H2O ;②4S2O42-+ 2NO2+8OH=8SO32-+N2+4H2O
【解析】
试题分析:(1)根据盖斯定律,②①,整理可得:C(s)+2NO(g) ==CO2(g)+N2(g) ΔH=574.1kJ/mol。
(2)根据三段式求解可得:
SO2(g)+Cl2(g) ![]() SO2Cl2(g)
SO2Cl2(g)
起始(mol) n n 0
转化(mol) x x x
平衡(mol) n-x n-x x
由同温同压下,气体的体积之比等于物质的量之比可知:![]() ,解得
,解得![]() 0.4n mol。
0.4n mol。
①由上述计算可知,v(SO2)![]() mol/min。②平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,故此温度下,该反应的化学平衡常数K=
mol/min。②平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,故此温度下,该反应的化学平衡常数K=![]() 。③由上述计算可知,将n mol SO2与n mol Cl2充入容积可变的密闭容器中,得到SO2Cl2 0.4n mol,恒温恒压条件下,将0.5n mol SO2与 0.5n mol Cl2充入该容器,与原平衡比值相同,则到达平衡状态时与原平衡等效,故将0.5n mol SO2与 0.5n mol Cl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是0.2n mol;
。③由上述计算可知,将n mol SO2与n mol Cl2充入容积可变的密闭容器中,得到SO2Cl2 0.4n mol,恒温恒压条件下,将0.5n mol SO2与 0.5n mol Cl2充入该容器,与原平衡比值相同,则到达平衡状态时与原平衡等效,故将0.5n mol SO2与 0.5n mol Cl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是0.2n mol;
(3)SO2与氨水混合发生反应产生NH4HSO3,向该溶液中通入NO2气体,与NH4HSO3电离产生的HSO3-发生氧化还原反应,根据电子守恒、电荷守恒、原子守恒,可得反应的离子方程式:2NO2+4HSO3-=N2+4SO42-+4H+;
(4)①由图可知,b极上HSO3-得电子发生还原反应生成S2O42-,则a电极为正极,b电极为负极,阴极的电极反应式为2HSO3-+2H++2e= S2O42-+2H2O;②阴极排出的溶液中含有S2O42-,在碱性条件下,使NO2转化为无害气体N2,同时自身被氧化为SO32-,则该反应的离子方程式为4S2O42-+ 2NO2+8OH= 8SO32-+N2+4H2O。

 阅读快车系列答案
阅读快车系列答案【题目】
步骤 | 实验过程 | 实验用品 |
I | 将干海带灼烧灰化 |
|
II | 将海带灰溶解、过滤 |
|
III | 氧化滤液中的I-,反应的离子方程式为 ② |
|
IV | 取少量III中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到 ③ ,说明海带中含有碘元素 |
|
(2)利用新制氨水、1mol/L NaBr溶液、淀粉液、以及II中所得溶液,验证卤素单质氧化性的相对强弱。
V分别取5mL 1mol/L NaBr溶液于两支小试管中
VI向两支试管中分别滴加5滴新制氯水,溶液均变为黄色
VII向其中一支试管中继续滴加新制氯水,直至溶液变为棕红色
VIII……
④请写出步骤VI中反应的离子方程式 ;为验证溴的氧化性强于碘,步骤VIII的操作和现象是: ,溶液变为黄色。再加入 ,溶液变为蓝色。
⑤步骤VII的目的是 。
⑥氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下, ,得电子能力逐渐减弱,非金属性减弱。