题目内容
12.已知平衡:①C2H4(g)?C2H2(g)+H2(g),
②2CH4(g)?C2H4(g)+2H2(g).当升高温度时,①和②式皆向右移动.
(1)C(s)+2H2(g)?CH4(g)△H1
(2)2C(s)+H2(g)?C2H2(g)△H2
(3)2C(s)+2H2(g)?C2H4(g)△H3
下列有关(1)、(2)和(3)中的△H1、△H2、△H3大小顺序排列正确的是( )
| A. | △H1>△H2>△H3 | B. | △H2>△H3>2△H1 | C. | △H2>△H1>△H3 | D. | △H3>△H2>2△H1 |
分析 先根据温度变化所引起平衡移动的方向判断反应①、反应②的热效应,当升高温度时,①和②式皆向右移动,说明该反应正向为吸热反应,然后利用已知方程式结合盖斯定律判断,利用盖斯定律,2×[(2)-(3)],得到C2H4(g)?C2H2(g)+H2(g),得:△H2、△H3关系;利用盖斯定律,(3)-2×(1),得△H3、2△H1关系,据此分析解答.
解答 解:当升高温度时,反应①C2H4(g)?C2H2(g)+H2(g),的平衡向右移动,说明该反应正向为吸热反应,△H>0,反应②2CH4(g)?C2H4(g)+2H2(g)的平衡向右移动,说明该反应正向为吸热反应,△H>0,
(1)C(s)+2H2(g)?CH4(g)△H1
(2)2C(s)+H2(g)?C2H2(g)△H2
(3)2C(s)+2H2(g)?C2H4(g)△H3
利用盖斯定律,2×[(2)-(3)],得到C2H4(g)?C2H2(g)+H2(g),△H=2(△H2-△H3),与题干中的①中的方程式一样,而①中的反应为吸热反应,△H>0,则△H2-△H3>0,所以△H2>△H3,
同理:(3)-2×(1),得到2CH4(g)?C2H4(g)+2H2(g),△H=△H3-2△H1
,与题干中的②中的方程式一样,而②中的反应为吸热反应,则△H3-2△H1>0,所以△H3>2△H1;
综上所述△H2>△H3>2△H1,
故选B.
点评 本题主要考查了盖斯定律的运用,题目难度中等,注意利用盖斯定律和已知方程式构建:△H2、△H3关系以及△H3、2△H1关系是解答关键.

练习册系列答案
相关题目
2.如图a、b、c、d均为石墨电极,通电进行电解(电解液足量)下列说法正确的是( )
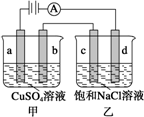

| A. | 向乙中加入适量盐酸,溶液组成可以恢复 | |
| B. | 电解时向乙中滴入酚酞溶液,c电极附近变红 | |
| C. | 当b极有64gCu析出时,c电极产生2g气体 | |
| D. | 甲中a极上的电极反应式为:4OH--4e-=O2↑+2H2O |
3.下列有关物质水解的说法正确的是( )
| A. | 淀粉、纤维素最终水解产物均为单糖 | |
| B. | 蛋白质最终水解产物是多肽 | |
| C. | 蔗糖、麦芽糖水解产物相同 | |
| D. | 酯在强碱作用下水解生成对应的酸和醇 |
20.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 向Zn与稀硫酸反应的溶液中滴加硫酸铜溶液 | 产生气体的速率加快 | 硫酸铜作该反应的催化剂 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
7.分子式为C4H8O2,只含一种官能团且为含氧官能团的有机物有(不考虑立体异构)( )
| A. | 15种 | B. | 6种 | C. | 4种 | D. | 2种 |
4.能正确表示下列反应的离子方程式的是( )
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| B. | 向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1 LpH=13的NaOH溶液中,由水电离出的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 2L0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA |
2.燃烧氢气时耗氧量小,放出热量多,已知4g H2燃烧生成液态水时放出热量为571.6kJ,表示H2燃烧热的热化学方程式为( )
| A. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | B. | 2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ/mol |
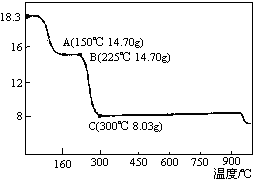 草酸钴是制备钴的氧化物的重要原料.如图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.
草酸钴是制备钴的氧化物的重要原料.如图为二水合草酸钴(CoC2O4•2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.