题目内容
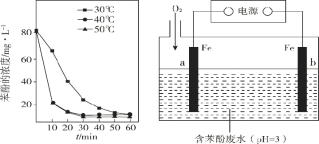
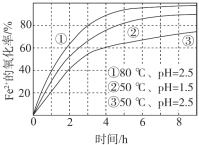
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。
4Fe2+(aq)+4H+(aq)+O2(g)=4Fe3+(aq)+2H2O(l) ΔH>0
下列分析或推测合理的是
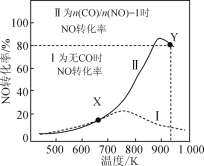
A.由①、②可知,pH越大,Fe2+越易被氧化
B.由②、③推测,若pH>7,Fe2+更难被氧化
C.pH=2.5、70℃时,0~3 h内Fe2+的平均消耗速率ν(Fe2+) < ![]() mol/(L·h)
mol/(L·h)
D.曲线②的变化趋势推测,反应吸热使得溶液温度下降,反应速率下降
【答案】C
【解析】
A.①、②中温度和pH均不同,存在两个变量,不能判断pH对反应的影响,故A错误;
B.若pH>7,+2价铁会转化为氢氧化亚铁沉淀,氢氧化亚铁在空气中能被氧气氧化生成氢氧化铁,所以+2价铁易被氧化,无法由②、③推测, pH>7时,Fe2+更难被氧化,故B错误;
C.由①和③可知,温度越高,Fe2+氧化速率越快,pH=2.5、80℃时,0~3 h内Fe2+的平均消耗速率ν(Fe2+) =![]() mol/(L·h),则当温度为70℃时,ν(Fe2+) <
mol/(L·h),则当温度为70℃时,ν(Fe2+) <![]() mol/(L·h),故C正确;
mol/(L·h),故C正确;
D.曲线②的变化趋势推测,反应速率降低,原因为反应物浓度减小,无法推测是因为温度降低导致反应速率下降,故D错误;
故选C。

练习册系列答案
相关题目