题目内容
【题目】利用甲醇(CH3OH)制备一些高附加值产品,是目前研究的热点。
(1)甲醇和水蒸气经催化重整可制得氢气,反应主要过程如下:
反应Ⅰ. CH3OH(g)+H2O(g)![]() 3H2(g)+CO2(g) △H1
3H2(g)+CO2(g) △H1
反应Ⅱ. H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2= a kJ·mol-1
H2O(g)+CO(g) △H2= a kJ·mol-1
反应Ⅲ. CH3OH(g)![]() 2H2(g)+CO(g) △H3= b kJ·mol-1
2H2(g)+CO(g) △H3= b kJ·mol-1
反应Ⅳ. 2CH3OH(g)![]() 2H2O(g)+C2H4(g) △H4= c kJ·mol-1
2H2O(g)+C2H4(g) △H4= c kJ·mol-1
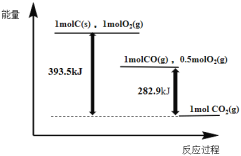
①△H1=______kJ·mol-1 。
②工业上采用CaO吸附增强制氢的方法,可以有效提高反应Ⅰ氢气的产率,如图1,请分析加入CaO提高氢气产率的原因:______。

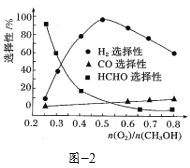
③在一定条件下用氧气催化氧化甲醇制氢气,原料气中![]() 对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制
对反应的选择性影响如题图2所示(选择性越大表示生成的该物质越多)。制备H2时最好控制![]() =______,当
=______,当![]() = 0.25时,CH3OH和O2发生的主要反应方程式为______。
= 0.25时,CH3OH和O2发生的主要反应方程式为______。
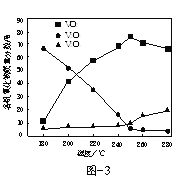
(2)以V2O5为原料,采用微波辅热-甲醇还原法可制备VO2,在微波功率1000kW下,取相同质量的反应物放入反应釜中,改变反应温度,保持反应时间为90min,反应温度对各钒氧化物质量分数的影响曲线如图3所示,温度高于250℃时,VO2的质量分数下降的原因是______。
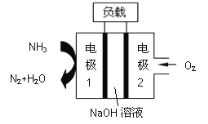
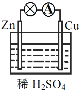
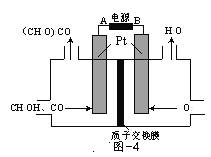
(3)以甲醇为原料,可以通过电化学方法合成碳酸二甲酯[(CH3O)2CO],工作原理如图4所示。
①电源的负极为______(填“A”或“B”)。
②阳极的电极反应式为______。
【答案】b –a CaO消耗CO2,降低CO2的浓度,促进平衡正向移动,提高H2的产率 0.5 2CH3OH+O2![]() 2HCHO+2H2O 甲醇继续还原VO2为V2O3 B 2CH3OH+CO 2e=(CH3O)2CO+2H+
2HCHO+2H2O 甲醇继续还原VO2为V2O3 B 2CH3OH+CO 2e=(CH3O)2CO+2H+
【解析】
(1)①这是一道典型的盖斯定律的应用,按要求来解题即可;
②氧化钙是碱性氧化物,二氧化碳是酸性氧化物,因此二者可以反应得到碳酸钙,二氧化碳被消耗后相当于生成物浓度降低,平衡将正向移动;
③根据题图不难看出最佳的投料比为0.5,当投料比为0.25时,甲醛的选择性非常高,因此此时主要是生成甲醛的反应;
(2)当温度升高时我们可以发现![]() 的质量分数在上升,温度升高后甲醇的还原性增强,将
的质量分数在上升,温度升高后甲醇的还原性增强,将![]() 进一步还原为
进一步还原为![]() ;
;
(3)根据装置图不难看出右侧在得电子,左侧在失电子,因此右侧为阴极,左侧为阳极,据此来解答即可。
(1)①不难看出,只要用反应III减去反应II,就可以得到![]() ,因此热效应也为反应III减去反应II,即
,因此热效应也为反应III减去反应II,即![]() ;
;
②氧化钙是碱性氧化物,二氧化碳是酸性氧化物,因此二者可以反应得到碳酸钙,二氧化碳被消耗后相当于生成物浓度降低,平衡将正向移动;
③根据题图不难看出,当投料比为0.5时,氢气的选择性最大,即可以得到更多的氢气,当投料比为0.25时,甲醛的选择性更大,即可以得到更多的甲醛![]() ;
;
(2)温度升高后甲醇的还原性增强,将![]() 进一步还原为
进一步还原为![]() ,因此
,因此![]() 的质量分数下降;
的质量分数下降;
(3)①右侧氧气得电子变成水,因此右侧是阴极,与阴极相连的B为电源负极,同理,左侧A为正极,与A相连的为阳极;
②阳极是甲醇、一氧化碳失电子变为碳酸二甲酯,据此写出电极反应式:![]() 。
。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案