题目内容
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50~60℃下发生反应,直至反应结束。
④除去混合酸后,粗产品依次用H2O和5%NaOH溶液洗涤,最后再用H2O洗涤。
⑤将污水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是_____________________________________。
(2)步骤③中,为了使反应在50~60℃下进行,可采用的方法是________________________________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是____________________;步骤④中粗产品用5%NaOH溶液洗涤的目的是__________________________________________________。
(4)实验室制备常用改进装置进行苯和溴的取代反应。如实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
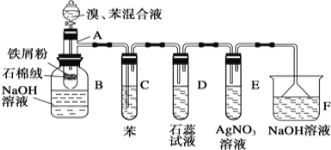
向反应容器A中逐滴加入溴和苯的混合液,几秒中内就发生反应。写出A中所发生反应的化学方程式:_________________________________________________。
(5)试管C中苯的作用是_________________________。反应开始后,观察D和E两试管,看到的现象为___________________________________,________________________________。
(6)反应2~3min后,在B中的NaOH溶液里可观察到的现象是_______________________________。
(7)同学甲认为,在上述整套装置中D和E两试管中的导管应插入液面下,实验现象更明显,请评价同学甲的改进建议:______________________________________________。
【答案】先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却 将反应器放在50~60℃(或60℃)的水浴中加热 分液漏斗 除去粗产品中残留的酸 2Fe+3Br2→2FeBr3 ![]() +Br2
+Br2![]() +HBr 吸收HBr气体中的Br2蒸气 D中紫色石蕊溶液变红,E中产生淡黄色沉淀 溶液中有红褐色的絮状物生成,底部有无色油状物质生成,液面上有白雾 HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸,装置D、E中导管口在液面上方,能防止倒吸
+HBr 吸收HBr气体中的Br2蒸气 D中紫色石蕊溶液变红,E中产生淡黄色沉淀 溶液中有红褐色的絮状物生成,底部有无色油状物质生成,液面上有白雾 HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸,装置D、E中导管口在液面上方,能防止倒吸
【解析】
(1)混合时先加密度小的,后加密度大的液体,偏于充分混合、散热;
(2)水浴加热可保存温度恒定;
(3)分离互不相溶的液态,采取分液操作;硝基苯产品中可能混有酸,而酸与碱反应后,与硝基苯分层;
(4)溴和苯在催化剂条件下发生取代反应生成溴苯;
(5)溴苯中的溴易挥发,溴易溶于苯,所以试管C中苯的作用是吸收吸收HBr气体中的Br2蒸气,该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸是酸性物质,能使紫色石蕊试液变红色;氢溴酸能和硝酸银反应生成淡黄色沉淀溴化银;
(6)苯与液溴发生取代反应生成溴苯和溴化氢,溴苯是密度大于水,无色的油状液体,溴化氢易挥发,能与水蒸气结合成氢溴酸液滴,液面上有白雾,FeBr3与氢氧化钠反应生成红褐色的氢氧化铁;
(7)HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸,装置D、E中导管口在液面上方,能防止倒吸。
(1)配制一定比例浓硫酸与浓硝酸混和酸时,操作注意事项是先在反应器内加入浓硝酸,再将浓硫酸慢慢沿管壁加入且边加边搅拌(或振荡),使产生的热量及时散失,故答案为:先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却。
(2)步骤③中,为了使反应在55-60℃下进行,常用的方法是将反应器放在50~60℃(或60℃)的水浴中加热,其好处是受热均匀及便于控制温度,故答案为:将反应器放在50~60℃(或60℃)的水浴中加热。
(3)硝基苯不溶于水,分液即可,所用到的试剂是分液漏斗;由于生成的硝基苯中含有酸性物质硝酸、硫酸以及溶解的NO2等,所以粗产品用5%的NaOH溶液洗涤的目的是除H2SO4、HNO3、NO2等酸物质,故答案为:分液漏斗,除去粗产品中残留的酸。
(4)溴和苯在催化剂条件下发生取代反应生成溴苯,化学方程式为:2Fe+3Br2→2FeBr3,![]() +Br2
+Br2![]() +HBr,故答案为:2Fe+3Br2→2FeBr3,
+HBr,故答案为:2Fe+3Br2→2FeBr3,![]() +Br2
+Br2![]() +HBr。
+HBr。
(5)溴苯中的溴易挥发,依据相似相溶原理知,溴易溶于苯,所以试管C中苯的作用是吸收吸收HBr气体中的Br2蒸气,该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸是酸性物质,能使紫色石蕊试液变红色;氢溴酸能和硝酸银反应生成淡黄色沉淀溴化银,E管中出现浅黄色沉淀,反应的离子方程式为:Ag++Br-=AgBr↓,故答案为:吸收HBr气体中的Br2蒸气;D中紫色石蕊溶液变红;E中产生淡黄色沉淀。
(6)苯与液溴发生取代反应生成溴苯和溴化氢,溴苯是密度大于水,无色的油状液体,溴化氢易挥发,能与水蒸气结合成氢溴酸液滴,液面上有白雾,FeBr3与氢氧化钠反应生成红褐色的氢氧化铁,故答案为:溶液中有红褐色的絮状物生成,底部有无色油状物质生成,液面上有白雾。
(7)在整套装置中D和E两试管中的导管应插入液面下,实验现象更明显,因为HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸,装置D、E中导管口在液面上方,能防止倒吸,故答案为:HBr易溶于水,直接将导管伸入水溶液液面以下,会发生倒吸,装置D、E中导管口在液面上方,能防止倒吸。

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
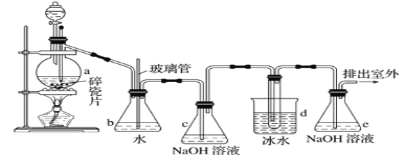
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】抗爆剂的添加剂常用1,2-二溴乙烷。如图为实验室制备1,2-二溴乙烷的装置图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:①_____________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②___________________________________;
安全瓶b还可以起到的作用是③___________________________。
(2)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________________。
(3)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正确情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:_____________________、_____________________________(写出两条即可)。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为________________,要进一步提纯,下列操作中必需的是
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是___________。