题目内容
9.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1 mol 苯含有6 NA个C-H键 | |
| B. | 常温常压下,22.4 L H2O含有3NA个原子 | |
| C. | 1L 0.1 mol•L-1NaHCO3溶液中含有0.1NA个HCO3- | |
| D. | 23g Na与足量H2O反应完全共转移2NA个电子 |
分析 A.1个苯分子含有6个C-H键;
B.气体摩尔体积使用对象为气体;
C.碳酸氢根离子在水溶液中存在电离和水解;
D.钠为1价金属,23g钠的物质的量为1mol,完全反应失去1mol电子;
解答 解:A.1个苯分子含有6个C-H键,1 mol 苯含有6 NA个C-H键,故A正确;
B.常温常压下,Vm≠22.4L/mol,故B错误;
C.碳酸氢根离子在水溶液中存在电离和水解,所以1L 0.1 mol•L-1NaHCO3溶液中含有小于0.1NA个HCO3-,故C错误;
D.23g钠的物质的量为1mol,完全反应失去1mol电子,失去电子数为NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
相关题目
20.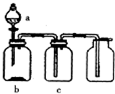 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )| 选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
| A | 稀盐酸 | 铁粉 | H2O | 制备并收集H2 |
| B | 稀硫酸 | Na2SO3粉末 | 浓硫酸 | 制备并收集干燥的SO2 |
| C | 浓盐酸 | KmnO4粉末 | NaOH溶液 | 制备并收集Cl2 |
| D | 浓氨水 | 生石灰 | 碱石灰 | 制备并收集干燥的NH3 |
| A. | A | B. | B | C. | C | D. | D |
4.原子序数依次增大的X、Y、Z、W四种短周期元素,X原子的最外层电子数与其电子层数相等,工业上一般用电解氧化物的方法得到Z的单质,W的核电荷数是Y核电荷数的2倍,X、Y两种元素可以形成原子数之比为1:1和2:1的化合物.下列说法正确的是( )
| A. | 由X、Y、Z组成的化合物既能与强碱溶液反应,又能与强酸溶液反应 | |
| B. | W的氢化物水溶液是强酸 | |
| C. | Y元素的氢化物在同周期中是最稳定的 | |
| D. | 元素Y和W只能形成一种化合物 |
14.能正确表示下列反应的离子方程式是( )
| A. | 稀硫酸中加入铜粉:Cu+2H+═Cu2++H2↑ | |
| B. | 用FeCl3溶液刻蚀铜制印刷电路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO32-+H2O | |
| D. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
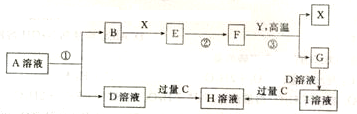
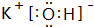 ,H的化学式为KHCO3;
,H的化学式为KHCO3; CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。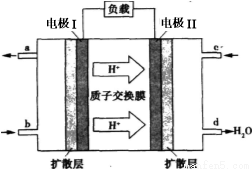
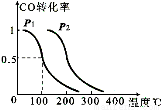
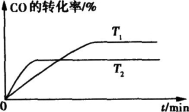
 =-483.6kJ/mol
=-483.6kJ/mol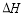 =+67.7kJ/mol
=+67.7kJ/mol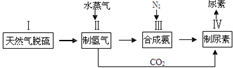
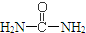 ,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.