题目内容
18.NA 表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol.L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na 2S和Na2O2 的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.5mol氧单质含有NA个O2 |
分析 A、铁和氯气反应生成氯化铁,依据全部反应的物质计算电子转移;
B、12.5mL 16mol/L浓硫酸溶质物质的量=0.0125L×16mol/L=0.2mol,全部反应生成二氧化硫0.1mol,随反应进行浓度减小,稀硫酸不和铜反应;
C、Na2S和Na2O2的摩尔质量都是78g/mol,7.8g 混合物的物质的量为0.1mol,硫化钠是由钠离子与硫离子构成,过氧化钠由钠离子与过氧根离子构成,每摩尔Na2S和Na2O2都含1mol阴离子;
D、氧元素的单质有O2和O3两种.
解答 解:A、5.6g铁粉物质的量为0.1mol,在0.1mol氯气中充分燃烧,氯气全部反应转移电子数为0.2NA,故A错误;
B、12.5mL 16mol/L浓硫酸溶质物质的量=0.0125L×16mol/L=0.2mol,全部反应生成二氧化硫0.1mol,随反应进行浓度减小,稀硫酸不和铜反应,转移的电子数小于0.1NA,故B错误;
C、Na2S和Na2O2的摩尔质量都是78g/mol,7.8g 混合物的物质的量为0.1mol,硫化钠是由钠离子与硫离子构成,过氧化钠由钠离子与过氧根离子构成,每摩尔Na2S和Na2O2都含1mol阴离子,所以7.8g Na2S和Na2O2的混合物中含有的阴离子为0.1mol,阴离子数等于0.1NA,故C正确;
D、氧元素的单质有O2和O3两种,故0.5mol氧单质不一定是0.5NA个氧气分子,还有可能是0.5NA个臭氧分子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
6.如图是198K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是 ( )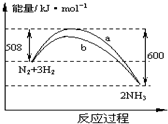

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 加入催化剂,该化学反应的反应热改变 | |
| C. | b曲线是加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
13.有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)X元素在周期表中的位置是第二周期第IVA族,其相对分子质量最小的气态氢化物的化学式是CH4.
(2)Y离子半径比Z离子的半径大(填“大”或“小”),Y元素的最高价氧化物的水化物和Z元素的最高价氧化物相互反应的离子方程式是:Al2O3+2OH-=2AlO2-+H2O.
(3)X与M两元素的气态氢化物的稳定性更强的是HCl(填化学式),请再举出一个实例比较M与X两元素的非金属性强弱(用化学方程式表示)Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.
| 元素 | 结构、性质等信息 |
| X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)X元素在周期表中的位置是第二周期第IVA族,其相对分子质量最小的气态氢化物的化学式是CH4.
(2)Y离子半径比Z离子的半径大(填“大”或“小”),Y元素的最高价氧化物的水化物和Z元素的最高价氧化物相互反应的离子方程式是:Al2O3+2OH-=2AlO2-+H2O.
(3)X与M两元素的气态氢化物的稳定性更强的是HCl(填化学式),请再举出一个实例比较M与X两元素的非金属性强弱(用化学方程式表示)Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.
3.设NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 1.7克氢氧根离子(OH-)含有的电子数为 NA | |
| B. | 7克乙烯(CH2=CH2)所含的电子数为4NA | |
| C. | 标准状况下,22.4L一氧化碳所含的分子数为 NA | |
| D. | 1molFe分别与氯气和硫反应失去电子都是3NA |
7.以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)?2CO2(g)+H2O(l)△H=-1 300kJ•mol-1的说法中,正确的是( )
| A. | 当10NA个电子转移时,该反应放出1 300 kJ的能量 | |
| B. | 当1NA个水分子生成且为液体时,吸收1300 kJ的能量 | |
| C. | 当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 | |
| D. | 当4NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
8.水溶液中能大量共存的一组离子是( )
| A. | pH=1的溶液中:Fe2+、CH3COO-、K+、SO42- | |
| B. | 在含较多Al3+的溶液中:Na+、Cl-、HCO3- | |
| C. | 在0.1 mol•L-1 CaCl2溶液中:K+、Ba2+、I-、OH- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO${\;}_{3}^{-}$ |
