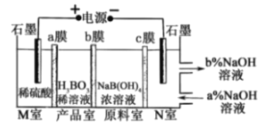
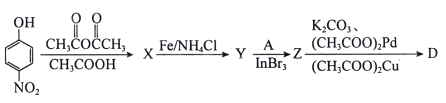
题目内容
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
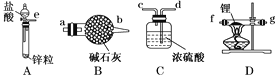
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置接口的连接顺序为___,加入药品前首先要进行的实验操作是___(不必写出具体的操作方法);其中装置B的作用是___。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯(一种有机化合物)中浸洗数次,该操作的目的是除去锂表面的石蜡,然后快速把锂放入到石英管中。通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作是___。
(3)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。分析该反应原理,完成LiH与水反应的化学方程式___。
(4)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为___。
【答案】e接a,b接f,g(或者f,g)接d 检验装置的气密性 除去H2中的H2O和HCl 收集c处排出的气体并检验H2纯度 LiH+H2O=LiOH+H2↑ 10∶1
【解析】
A中锌与盐酸反应生成氯化锌和氢气,用B中的碱石灰除去杂质氯化氢并干燥氢气,C装置中氢气与金属锂反应生成LiH,最后连接浓硫酸,可以防止空气中的水蒸气进入C。据此解答。
(1)A中锌与盐酸反应生成氯化锌和氢气,e接a用B中的碱石灰除去杂质氯化氢并干燥氢气,b接f在C装置中氢气与金属锂反应生成LiH,g接d,可以防止空气中的水蒸气进入C,所以仪器装置接口的连接顺序为e接a,b接f,g(或者f,g)接d;涉及气体的实验,加入药品前首先要进行的实验操作是检验装置的气密性;装置B中盛放的碱石灰,作用是除去H2中的H2O和HCl。
(2)加热氢气与氧气的混合气体,易爆炸,所以加热D处的石英管之前,必须收集c处排出的气体并检验H2纯度。
(3)LiH与水反应生成氢氧化锂和氢气,反应的化学方程式是LiH+H2O=LiOH+H2↑。
(4)共收集到氢气的体积是470.4mL,物质的量是![]() ;设样品中LiH与Li的物质的量分别是xmol、ymol,则8x+7y=0.174①;根据反应方程式LiH+H2O=LiOH+H2↑、2Li+2H2O=2LiOH+H2↑,则
;设样品中LiH与Li的物质的量分别是xmol、ymol,则8x+7y=0.174①;根据反应方程式LiH+H2O=LiOH+H2↑、2Li+2H2O=2LiOH+H2↑,则![]() 0.021mol②;联立①②,解得x=0.02,y=0.002;则产品中LiH与Li的物质的量之比为10:1。
0.021mol②;联立①②,解得x=0.02,y=0.002;则产品中LiH与Li的物质的量之比为10:1。