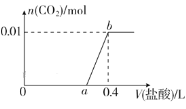
题目内容
【题目】钇钡铜氧、汞钡铜氧、汞钡钙铜氧等都是常见的高温超导体。回答下列问题:
(1)钇(39Y)是一种重要的稀土金属,基态Y原子的价电子排布式为______。下列科学家中,在稀土化学领域做出重要贡献的是_________(填标号)。
a.侯德榜 b.屠呦呦 c.徐光宪
(2)BaCO3可用于制备上述高温超导体,其3种组成元素中,第一电离能最大的是______(填元素符号),CO32-的空间构型为________,其中碳原子的杂化方式为________________。
(3)汞钡铜氧晶体的晶胞如下图A所示,通过掺杂Ca2+获得的具有更高临界温度的超导材料如图B所示。
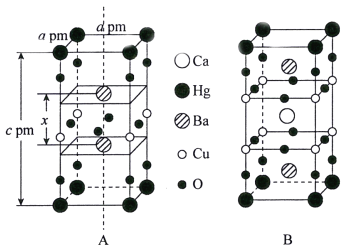
汞钡铜氧晶体的密度为______g·cm-3(设NA为阿伏加德罗常数的值)。图A晶胞中钡离子的分数坐标为(![]() )和_________。掺杂Ca2+所得超导材料的化学式为_________。
)和_________。掺杂Ca2+所得超导材料的化学式为_________。
【答案】4d15s2 C O (正)三角形 sp2 6.02×1032/a2cNA (1/2,1/2,(1-x)/2) HgBa2CaCu2O6
【解析】
(1)钇(39Y)为39号元素,基态Y原子的价电子排布式为:4d15s2,侯德榜创制侯氏制碱法,屠呦呦创制新型抗疟药青蒿素和双氢青蒿素,徐光宪发现了稀土溶剂萃取体系具有“恒定混合萃取比”基本规律,提出了适于稀土溶剂萃取分离的串级萃取理论,故稀土化学领域做出重要贡献的是徐光宪,故答案为:4d15s2;c;
(2)同周期,从左到右,第一电离能增大;同主族,从上到下,第一电离能减小,Ba、C、O中,第一电离能最大是O元素,CO32-中中心原子的价电子对数=孤电子对数+![]() 键=
键=![]() 键=0+3=3,所以空间构型为:正三角形,其中碳原子的杂化方式为:sp2,故答案为:O;正三角形;sp2;
键=0+3=3,所以空间构型为:正三角形,其中碳原子的杂化方式为:sp2,故答案为:O;正三角形;sp2;
(3)根据汞钡铜氧晶体的结构可知,晶胞中含有Hg有8×1/8=1个、Ba有2个、Cu有4×1/4=1个、O有8×1/4+4×1/2=4个,其密度为:![]() g·cm-3,图A晶胞中钡离子的分数坐标为(
g·cm-3,图A晶胞中钡离子的分数坐标为(![]() )和(
)和(![]() ),根据掺杂Ca2+所得超导材料的结构可知,晶胞中含有1个Ca、1个Hg、2个Ba、1个Cu、6个O,化学式为:HgBa2CaCu2O6,故答案为:
),根据掺杂Ca2+所得超导材料的结构可知,晶胞中含有1个Ca、1个Hg、2个Ba、1个Cu、6个O,化学式为:HgBa2CaCu2O6,故答案为:![]() ;(
;(![]() );HgBa2CaCu2O6。
);HgBa2CaCu2O6。

【题目】已知有位于元素周期表前四周期的元素X、Y、Z、T、W、Q,其部分信息如下表:
X | 宇宙中含量最丰富的元素 |
Y | 植物生长所必需的三种营养元素中,电负性最大的 |
Z | 原子最外层电子数是其电子层数的3倍 |
Q | 其气态氢化物与其低价氧化物常温下能反应,生成该元素的单质 |
T | 最高正价与最低负价代数和为6,其单质能与强碱溶液反应制消毒液 |
W | 其+2价阳离子的价电子排布为3d9 |
请回答下列问题:
(1)W元素位于周期表的第___周期___族,W2+能与X、Y形成的简单分子结合生成一种深蓝色的离子,其离子符号为___。
(2)X与Z按原子个数比为1:1组合得到的一种物质甲,它能用于杀菌消毒,物质甲的电子式为___;Q与T也能按原子个数比为1:1组合,得到一种暗黄色的液体乙,其结构与甲相似,则乙中存在的化学键类型有___和___;乙遇水发生歧化反应,得到一种淡黄色的固体和两种具有刺激性气味的气体,该反应的化学反应方程式为___。
(3)元素Q的简单离子半径___元素T的简单离子半径(填“>”“<”或“=”);元素T能形成多种含氧酸:HTO、HTO2、HTO3、HTO4,其酸性由强到弱的顺序为___(用化学式表示)。
【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
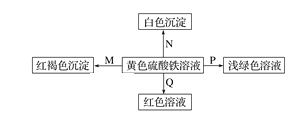
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | KSCN |
A.AB.BC.CD.D
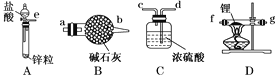
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |