题目内容
6.将铁和氧化铁的混合物15g,加入150mL稀硫酸中,在标准状况下放出氢气1.68L,同时铁和氧化铁均无剩余.向溶液中滴入硫氰化钾溶液,未见颜色变化.为了中和过量的硫酸,而且使铁完全转化成Fe(OH)2,共消耗3mol•L-1的氢氧化钠溶液200mL,原硫酸溶液的浓度是( )| A. | 1.5mol•L-1 | B. | 2mol•L-1 | C. | 2.5mol•L-1 | D. | 3mol•L-1 |
分析 将铁和氧化铁的混合物加入稀硫酸中,产生气体,向溶液中滴入硫氰化钾溶液,未见颜色变化,说明生成硫酸亚铁,中和过量的硫酸,而且使铁完全转化成氢氧化亚铁,产生溶液中溶质为Na2SO4,根据硫酸根守恒可知n(H2SO4)=n(Na2SO4),根据钠离子守恒n(NaOH)=2n(Na2SO4),据此计算n(H2SO4),再根据c=$\frac{n}{V}$计算.
解答 解:将铁和氧化铁的混合物加入稀硫酸中,产生气体,向溶液中滴入硫氰化钾溶液,未见颜色变化,说明生成硫酸亚铁,中和过量的硫酸,而且使铁完全转化成氢氧化亚铁,产生溶液中溶质为Na2SO4,根据硫酸根守恒可知n(H2SO4)=n(Na2SO4),根据钠离子守恒n(NaOH)=2n(Na2SO4),
故n(H2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.2L×3mol/L=0.3mol,故c(H2SO4)=$\frac{0.3mol}{0.15L}$=2mol/L,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,明确反应的实质是解答关键,试题侧重考查学生分析思维能力,注意利用守恒法进行计算.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
16.在一定温度下,恒容密闭容器中,充入一定量的NO和O2,发生反应O2(g)+2NO(g)?2NO2(g),反应已达到平衡的标志是( )
| A. | 混合气体的颜色不再变化 | |
| B. | O2、NO、NO2三种物质的反应速率之比为1:2:2 | |
| C. | 反应混合物中各组分物质的浓度相等 | |
| D. | 混合气体的密度不再改变 |
17.下列关于离子反应及离子共存的说法中正确的是( )
| A. | 能使甲基橙显红色的溶液中,Ba2+、Fe2+、Cl-、NO3-可以大量共存 | |
| B. | AlCl3溶液中加入过量的氨水:Al3++4OH-═[Al(OH)4]- | |
| C. | 常温下,由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3-可以大量共存 | |
| D. | NaHCO3溶液中滴入少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
14.下列物质中属于有机物的是( )
①氰化钠(NaCN) ②丙酮 ③丁炔 ④碳化硅(SiC) ⑤碳酸 ⑥CO ⑦KSCN.
①氰化钠(NaCN) ②丙酮 ③丁炔 ④碳化硅(SiC) ⑤碳酸 ⑥CO ⑦KSCN.
| A. | ①②③④⑦ | B. | ①②③ | C. | ②③ | D. | 全部都是 |
1.下列各电子式中书写正确的是( )
| A. | 氮气 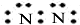 | B. | 氯化氢 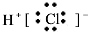 | C. | 氨气 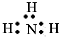 | D. | 氯化镁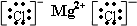 |
15.下列化合物中不含离子键的是( )
| A. | Na2O | B. | HCl | C. | CaCl2 | D. | Na2CO3 |
 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两 种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两 种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.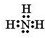

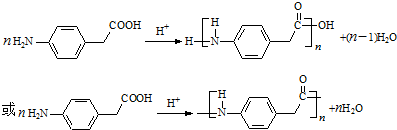 .
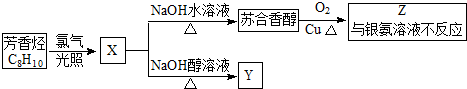
.
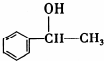 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.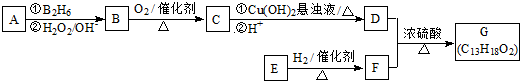
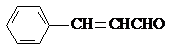 .
.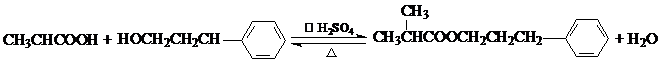 .
.