题目内容
10.下列各组分子中,都属于含极性键的非极性分子的是( )| A. | C2H4 CH4 | B. | CO2 H2S | C. | C60 C2H4 | D. | NH3 HCl |
分析 非极性键为:同种元素的原子间形成的共价键;极性键为:不同元素的原子间形成的共价键;
极性分子为:正电荷中心和负电荷中心不相重合的分子;非极性分子:正电荷中心和负电荷中心相重合的分子;分子极性的判断方法为:分子的极性由共价键的极性及分子的空间构型两个方面共同决定.
解答 解:A、C2H4中含有极性键和非极性键,是平面型分子,结构对称,分子中正负电荷重心重叠,为非极性分子,CH4 中含有极性键,为正四面体结构,结构对称,分子中正负电荷重心重叠,为非极性分子,故A正确;
B、二氧化碳为极性键形成的非极性分子,硫化氢为极性键形成的极性分子,故B错误;
C、C60是非极性键形成的非极性分子,C2H4中含有极性键和非极性键,是平面型分子,结构对称,分子中正负电荷重心重叠,为非极性分子,故C错误;
D、氨气和氯化氢都是由极性键形成的分子,二者正电荷中心和负电荷中心不相重合,属于极性分子,故D错误;
故选:A.
点评 本题考查了键的极性和分子的极性判断,题目难度不大,侧重于对学生灵活运用基础知识解决实际问题的能力的培养.

练习册系列答案
相关题目
1.下列各电子式中书写正确的是( )
| A. | 氮气 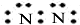 | B. | 氯化氢 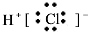 | C. | 氨气 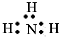 | D. | 氯化镁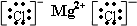 |
5.一定量的甲烷燃烧后得到CO、CO2及水蒸气,混合气共重49.6g,通过无水CaCl2时,CaCl2增重25.2g,则CO2的质量为( )
| A. | 12.5 g | B. | 13.2 g | C. | 19.7 g | D. | 24.4 g |
15.下列化合物中不含离子键的是( )
| A. | Na2O | B. | HCl | C. | CaCl2 | D. | Na2CO3 |
2.下列叙述正确的是( )
| A. | 硫酸钡的水溶液几乎不导电,所以硫酸钡是弱电解质 | |
| B. | 二氧化硫和二氧化氮的水溶液都能导电,所以二者都是电解质 | |
| C. | 氨气的水溶液可以导电,所以氨是电解质 | |
| D. | 氢氧化钙在水中的溶解度很小,但它溶解的部分完全电离,所以氢氧化钙是强电解质 |
20.下列说法不正确的是( )
| A. | 有机化合物中,σ键比π键重叠程度大,形成的共价键强 | |
| B. | N2H4分子中有5个σ键 | |
| C. | 气体单质中,一定有σ键,可能有π键 | |
| D. | 两种原子间形成共价键时,最多有一个σ键 |
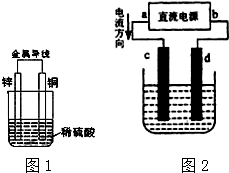 (1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)
(1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)
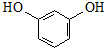
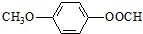
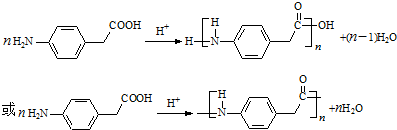 .
.