题目内容
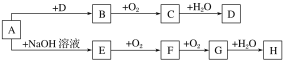
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是____________________________________。该装置中产生ClO2的化学方程式为_________________________________________。
(2)实验过程中需要持续通入空气,目的是_________________________________。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是________(填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为______________________________________;使用冰水浴的原因是_________________________________;反应结束后,从溶液中得到NaClO2固体的实验操作是____________________________________________________。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是___________g。
【答案】 关闭K1、K2,向分液漏斗中注入水,打开分液漏斗活塞,开始有少量水滴下,一段时间后,水不能滴下,说明装置A气密性良好 2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O 稀释ClO2,使生成的ClO2全部进入三颈瓶中 d 2ClO2+2OH-+H2O2=2 ClO2-+2H2O+O2 防止NaClO2分解 在38℃-60℃下,减压蒸发结晶过滤、洗涤、干燥 43.5a
【解析】试题分析:(1)根据压强原理,通过关闭K1、K2,向分液漏斗中注入水的方法检验装置A的气密性;根据得失电子守恒配平NaClO3、Na2SO3、H2SO4生成ClO2的方程式;(2)根据纯空气中ClO2的体积分数在10%以下比较安全分析;(3)根据亚氯酸钠(NaClO2)是漂白剂分析;(4)B装置中 ClO2、NaOH、H2O2反应生成NaClO2、O2;高于60℃时NaClO2分解成NaClO3和NaCl;NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2,要得到NaClO2需要控制温度蒸发结晶。(5)NaClO2在一定条件下可以将CN-氧化成二氧化碳和氮气,根据电子守恒,NaClO2与CN-的关系式是![]() ;
;
解析:(1). 关闭K1、K2,向分液漏斗中注入水,打开分液漏斗活塞,开始有少量水滴下,一段时间后,水不能滴下,说明装置A气密性良好;根据得失电子守恒,NaClO3、Na2SO3、H2SO4生成ClO2的方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;(3). 实验过程中需要持续通入空气的目的是稀释ClO2,使生成的ClO2全部进入三颈瓶中;(3亚氯酸钠(NaClO2)是漂白剂,能使石蕊、酚酞、pH试纸褪色,所以检测三颈瓶中溶液酸碱性用PH计,选d。(4) B装置中ClO2、NaOH、H2O2反应生成NaClO2、O2的离子方程式是2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2;高于60℃时NaClO2分解成NaClO3和NaCl,所以装置B使用冰水浴;NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2,要得到NaClO2需要在38℃-60℃下,减压蒸发结晶过滤、洗涤、干燥;(5)设理论上至少需要NaClO2的质量是xg;
![]()
452.5g 104g
Xg a![]() g·L-1
g·L-1![]()
![]()
X= 43.5a。

 阅读快车系列答案
阅读快车系列答案